
【题目】H2S水溶液中存在电离平衡H2S ![]() HS-+H+和HS-
HS-+H+和HS- ![]() S2-+H+,若向溶液中
S2-+H+,若向溶液中
A.加硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.通入氯气,溶液pH值增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如图:
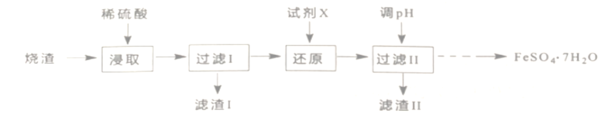
(1)滤渣I的主要成分是___(填化学式)。
(2)浸取过程中,可提高酸浸速率的措施有___ (任写一条)。
(3)还原时,若试剂X为一种单质,则X的化学式为___。
(4)若试剂X选用SO2,写出还原步骤的离子方程式:___。
(5)常见离子形成氢氧化物沉淀的pH见表,则该流程中pH应该调节为___(范围)。
pH | Al3+ | Fe2+ |
开始沉淀 | 3.0 | 5.8 |
完全沉淀 | 5.0 | 8.8 |
(6)从分离出滤渣II后的滤液中得到产品,应进行的操作是___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a g Mg、Al合金完全溶解在c1 mol/L、V1 L HCl溶液中,产生b g H2。再向反应后的溶液中加入c2 mol/L、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是
A. 与金属反应后剩余盐酸中HCl为(c1V1-b) mol
B. c1=![]()
C. 铝失去电子的物质的量为b mol
D. d=a+17b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质的量浓度相同的碳酸钠和偏铝酸钠的混合溶液中逐滴加入![]() 盐酸,溶液中相关离子的物质的量变化如图所示。下列说法正确的是
盐酸,溶液中相关离子的物质的量变化如图所示。下列说法正确的是
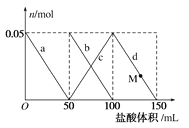
A.a曲线表示的离子方程式为![]()
B.当加入![]() 盐酸时,开始有二氧化碳生成
盐酸时,开始有二氧化碳生成
C.M点时,溶液中沉淀的质量为![]()
D.当加入![]() 盐酸时,氢氧化铝沉淀恰好完全溶解
盐酸时,氢氧化铝沉淀恰好完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中的曲线![]() 纵坐标为沉淀或气体的量,横坐标为加入物质的量
纵坐标为沉淀或气体的量,横坐标为加入物质的量![]() ,其中错误的是
,其中错误的是
A.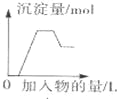 表示向含
表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液产生沉淀的关系曲线
的溶液中滴加NaOH溶液产生沉淀的关系曲线
B. 表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.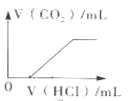 表示向NaOH和
表示向NaOH和![]() 的混合液中滴加盐酸产生
的混合液中滴加盐酸产生![]() 气体的关系曲线
气体的关系曲线
D. 表示向氯化铝和氯化镁溶液中滴加
表示向氯化铝和氯化镁溶液中滴加![]() 溶液产生沉淀量的关系曲线
溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
(1)氯化铁溶液腐蚀铜板的离子方程式: ______ .
(2)将5至6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体.
写出反应的离子方程式: ______ .
(3)向100mL![]() 硫酸铝铵
硫酸铝铵![]() 溶液中逐滴滴入
溶液中逐滴滴入![]()
![]() 溶液.随着
溶液.随着![]() 溶液体积V的变化,沉淀物质的量n的变化如图所示:
溶液体积V的变化,沉淀物质的量n的变化如图所示:
①请认真思考,写出相应的离子方程式:
OA段: ______
OB段: ______
BC段: ______
CD段: ______
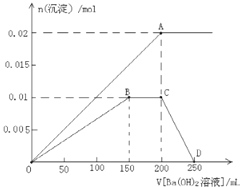
②当![]() 离子恰好全部沉淀时,生成
离子恰好全部沉淀时,生成![]() 物质的量为 ______ mol.
物质的量为 ______ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
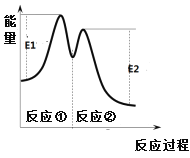
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com