


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
238 94 |
238 94 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
| C、分子间氢键会使物质的熔点沸点升高,而分子内氢键对熔沸点影响不大 |
| D、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 +H2O+H2SO4
+H2O+H2SO4 | 100~130℃ |
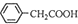 +NH4HSO4
+NH4HSO4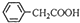 +Cu(OH)2→(
+Cu(OH)2→(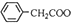 )2Cu+H2O
)2Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
| CH2(OCH3)2(mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
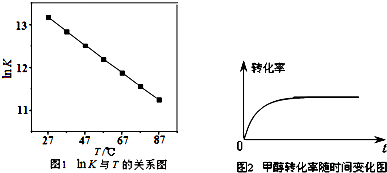
| 影响因素 试验号 |
甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率 |
| 1 | 70 | 2.5 | 30 | |
| 2 | 1.0 | |||
| 3 | 2.5 | 80 |
| CH3OH |
| H+ |
| CH3OH |
| -H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com