
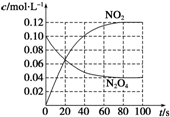
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| ||
|
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
| c(N2O4) |
| c(NO2) |
| 0.04 |
| 0.122 |
| 0.2mol |
| 2L |
 ,
, ;
;| 0.12mol |
| 0.2mol |
| 92g/mol×0.2mol |
| 0.32mol |
| c(N2O4) |
| c(NO2)2 |
| c(N2O4) |
| c(NO2)2 |


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
| A、H+,Cl-,Na+,ClO- |
| B、CO32-,HCO3-,K+,H+ |
| C、Ca2+,K+,H+,SiO32- |
| D、Na+,S2-,SO32-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、37.6% | B、36.8% |
| C、51.2% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极93.6g,阴极121.6g |
| B、阳极100 g,阴极128.0g |
| C、阳极91.0g,阴极119.0g |
| D、阳极86.0g,阴极114.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com