
已知反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )。
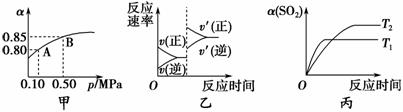
A.由图甲推断,B点SO2的平衡浓度为0.3 moL·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2的平衡转化率与温度关系如图丙,则T2>T1
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物。其合成线路如下:
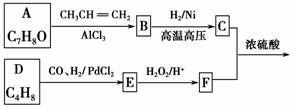


(1)A的名称为________。
(2)G中含氧官能团名称为________。
(3)D的分子中含有________种不同化学环境的氢原子。
(4)E与新制的氢氧化铜反应的化学方程式为__________________________
__________________________________________________________。
(5)写出符合下列条件的A的所有同分异构体的结构简式:____________。
a.分子中有6个碳原子在一条直线上;
b.分子中含有—OH。
(6)正戊醛可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
3个氨基酸(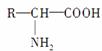 ,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
A.3∶3∶5 B.3∶5∶3
C.5∶3∶3 D.8∶7∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
碘水在水中的溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)I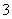 (aq)。测得不同温度下该反应的平衡常数如下表所示:
(aq)。测得不同温度下该反应的平衡常数如下表所示:
| T/℃ | 3.8 | 15.3 | 25.0 | 35.0 | 50.2 |
| K | 1 160 | 841 | 689 | 533 | 409 |
下列说法不正确的是 ( )。
A.上述反应的正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.向上述体系中加入苯,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。

| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一反应:2A+B2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是 ( )。
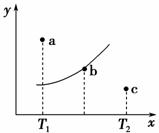
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
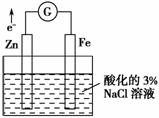
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应________
________________________________________________________________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设。
假设 1 :铁参与反应,被氧化生成Fe2+;
假设 2 :铁参与反应,被氧化生成Fe3+;
假设 3 :________________________________________________________。
(3)为了探究假设1 、2,他采取如下操作:
①取0.01 mol·L-1 FeCl3溶液 2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 KSCN 溶液,未见溶液变红。
据②、③、④现象得出的结论是__________________ _____________________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:_________________________________________________________________。
Ⅱ.利用如图所示装置做电解 50 mL 0.5 mol·L-1的 CuCl2 溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2 的氧化性强于IO );
);
B.电解一段时间以后,阴极表面除吸附有铜外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录 A 中试纸颜色的变化,用离子方程式解释:①________________②______________。
(2)分析实验记录 B 中浅蓝色固体可能是_____________________________
(写化学式),试分析生成该物质的原因:________________________________
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com