
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1-丁醇的结构简式可写作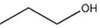 | |
| B. | 氨基酸合成多肽链属于加聚反应 | |
| C. | 分子式为C4H8O2,既含有羟基又含有醛基的同分异构体有5种 | |
| D. | 糖、油脂、蛋白质等这些人体必需的营养物质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
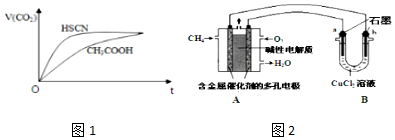
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
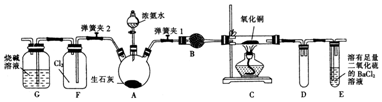
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
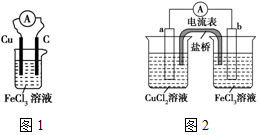 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
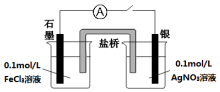 甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:
甲同学向做过银镜反应的试管0.1mol/L的Fe(NO3)3溶液(pH=2),发现银镜部分溶解,和大家一起分析原因:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒 | |
| B. | 中和热测定可以是所有的酸和碱 | |
| C. | 环形玻璃搅拌棒的搅拌方式是上下搅动 | |
| D. | 实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com