
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为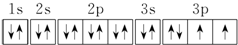 .
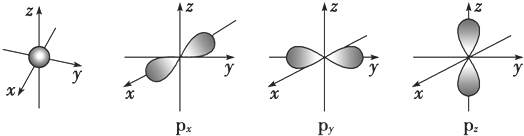
. 分析 (1)根据图片中轨道的形状进行分析解答,注意p能级有3个轨道;
(2)元素X的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级,说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,则该元素是N元素.
解答 解:(1)根据图片,s电子的原子轨道呈球形,含有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道,且这三个轨道相互垂直,
故答案为:球,1;纺锤,3;
(2)因为元素X的原子最外层电子排布式为nsnnn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,是氮元素,原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向,氢化物的电子式是 ;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素,原子的电子排布图为
;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素,原子的电子排布图为 ;故答案为:2p; 三个互相垂直的伸展; 氮;
;故答案为:2p; 三个互相垂直的伸展; 氮;  ;S;
;S; ;
;
点评 本题考查了原子核外电子排布及轨道伸展方向等知识点,正确推断元素是解本题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只要是甜的物质,都是糖类 | |
| B. | 单糖是不能发生水解的最简单的糖类 | |
| C. | 淀粉纤维素都是天然有机高分子化合物 | |
| D. | 蔗糖和麦芽糖均为二糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
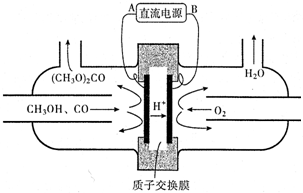
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
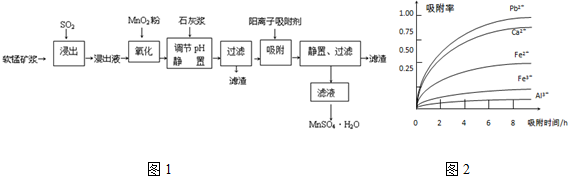
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com