
����Ŀ�������£����ȡ0.1 mol/LHA��Һ��0.1 mol/L NaOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��PH=8���Իش���������:
�Ż����Һ��pH=8��ԭ��(�����ӷ���ʽ��ʾ)��______________________��
�ƻ����Һ����ˮ�������c(H+)____0.1mol/L NaOH��Һ����ˮ�������c(H+)����������>������<������=����
(3)������Һ��������ʽ�ľ�ȷ������(���������)��c(Na+)-c(A-)=____mol/L��c(H+)+c(HA)=__mol /L��
����֪NH4A��ҺΪ���ԣ���֪HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��
pH___7(��������������С��������������������ͬ�¶��µ�Ũ�ȵ���������Һ��
A. NH4HCO3 B.NH4A C. (NH4)2SO4 D. NH4Cl
��pH�ɴ�С��˳�������ǣ�____________(�����)��
���𰸡� A-+H2O![]() HA +OH- > 9.9��10-7 10-6 ���� ABDC
HA +OH- > 9.9��10-7 10-6 ���� ABDC
����������1��25��ʱ�����������Ũ�ȵ�HA����������ǡ�÷�Ӧ�����Σ��ⶨ�����Һ��pH��7��˵������Һ�ʼ��ԣ��������ǿ�������Σ����������ˮ�⣬������Һ������������Ũ�ȴ���������Ũ�ȶ�ʹ��Һ�ʼ��ԣ�ˮ�����ӷ���ʽΪA-+H2O![]() HA +OH-����2����������ˮ���룬�����������ӵ��δٽ�ˮ���룬NaA�Ǻ����������ӵ��Σ�����������ǿ�����NaA�ٽ�ˮ���룬������������ˮ���룬������Һ����ˮ�������c��H+����0.1mol/LNaOH��Һ����ˮ�������c��H+������3����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=c��A-��+c��OH-��������c��Na+��-c��A-��=c��OH-��-c��H+��=10-6mol/L-10-8mol/L=9.9��10-7 mol/L�����������غ㣺c(H+)+c(HA)=c��OH-��=10-6 mol/L����4��HA��Һ�ӵ�Na2CO3��Һ��������ų���˵��HA�����Ա�̼���ǿ��NH4A��ҺΪ���ԣ�˵����ͬ�����£���ˮ��HA�ĵ���̶���ͬ�����ԣ�NH4��2CO3��笠����ӵ�ˮ��̶�С��̼������ӵ�ˮ��̶ȣ�������Һ��pH��7����5����NH4��2SO4 ��NH4Cl��ǿ�������Σ�笠�����ˮ�����Һ�����ԣ���Һ��笠�����Ũ��Խ��ˮ��̶�ԽС����ˮ��ĸ����࣬�����Ȼ����Һ��pHֵ��������泥�NH4A��Һ���������ӵ�ˮ��̶���ȣ�������Һ�����ԣ���Һ��pHֵ�����Ȼ�泥�NH4HCO3��Һ��笠����ӵ�ˮ��̶�С��̼��������ӵ�ˮ��̶ȣ���Һ�ʼ��ԣ�������Һ��pHֵ��ʴ�Ϊ��ABDC��
HA +OH-����2����������ˮ���룬�����������ӵ��δٽ�ˮ���룬NaA�Ǻ����������ӵ��Σ�����������ǿ�����NaA�ٽ�ˮ���룬������������ˮ���룬������Һ����ˮ�������c��H+����0.1mol/LNaOH��Һ����ˮ�������c��H+������3����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=c��A-��+c��OH-��������c��Na+��-c��A-��=c��OH-��-c��H+��=10-6mol/L-10-8mol/L=9.9��10-7 mol/L�����������غ㣺c(H+)+c(HA)=c��OH-��=10-6 mol/L����4��HA��Һ�ӵ�Na2CO3��Һ��������ų���˵��HA�����Ա�̼���ǿ��NH4A��ҺΪ���ԣ�˵����ͬ�����£���ˮ��HA�ĵ���̶���ͬ�����ԣ�NH4��2CO3��笠����ӵ�ˮ��̶�С��̼������ӵ�ˮ��̶ȣ�������Һ��pH��7����5����NH4��2SO4 ��NH4Cl��ǿ�������Σ�笠�����ˮ�����Һ�����ԣ���Һ��笠�����Ũ��Խ��ˮ��̶�ԽС����ˮ��ĸ����࣬�����Ȼ����Һ��pHֵ��������泥�NH4A��Һ���������ӵ�ˮ��̶���ȣ�������Һ�����ԣ���Һ��pHֵ�����Ȼ�泥�NH4HCO3��Һ��笠����ӵ�ˮ��̶�С��̼��������ӵ�ˮ��̶ȣ���Һ�ʼ��ԣ�������Һ��pHֵ��ʴ�Ϊ��ABDC��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ʒ�к���̼���Ƽ������������ƺ��Ȼ��ƣ�ijѧ��Ϊ�˼�����ɷ֣�������ͼ��ʾ�������ʵ�飬�뽫�����Լ����йؽ�����д����Ӧ�Ŀո��У� 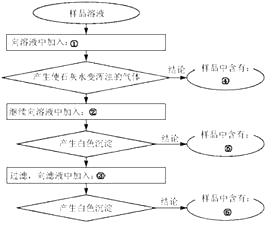
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����ǿ����ʣ�������ˮ�е��������������(ÿ������ֻ��һ���������һ����ظ�����
������ | Na+��Ba2+��NH4+ |
������ | CH3COO-��OH-��Cl-��SO42- |
��֪����A��C��Һ��pH������7��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ������
��A��_________��B��______________(�ѧʽ)��
�����ӷ���ʽ��ʾA��ˮ��Һ�д��ڵ�ƽ���ϵ��_______________________��
(2)д��C��D��Ӧ�����ӷ���ʽ____________________��
(3)25��ʱ��0.1 mol��L-1 B ��Һ�� pH=a����B��Һ�У�C(H+) -c(OH-)=_______(����Ũ�ȷ���)=____(�ú���a�Ĺ�ϵʽ��ʾ)��
�Ƚ�������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳����___________��
(5)��һ�������0.005 mol��L-1��C��Һ�У�����һ�������0.00125mol��L-1�����ᣬ�����Һ��pH=11������Ӧ����Һ���������C��Һ����������֮�ͣ���c��Һ��������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����29.5g��ϩ������Ļ������ͨ����������ˮ����ˮ����7g��������������ϩ����������ǡ�������������������������������������������������������
A��75% B��50% C��30% D��25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м��������������ʵ���Һ��������(��Һ����400��)���Եõ�ԭ���ʹ������
A��AlCl3 B��NaHCO3 C��MgSO4 D��KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������}��
(1)��ˮ��T��ʱ��pH��6�����¶���1 mol��L-1��NaOH��Һ�У���ˮ�������c(OH-)��________ mol��L-1��
(2)ijһԪ������Һ��A�����Ԫǿ�ᣨB����pH��ȡ���������Һϡ����ͬ�ı�����pH(A)___pH(B) ��������������=����������������������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A)_____V(B)��������������=��������������
��3����֪����Ԫ��H2R�ĵ��뷽��ʽ�ǣ�H2R=H++HR����HR��![]() R2��+H+��
R2��+H+��
����0.1molL-1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+)_____(0.1+a)molL��1����������������������=������������___________________��
�� NaHR��Һ��_____�ԣ�������___________________��
��ij�¶��£���10 mL��0.1 mol/L NaHA��Һ�м���0.1 mol/L KOH��ҺV mL�����ԣ���ʱ��Һ�����¹�ϵһ����ȷ����______(��д��ĸ)��
A.��Һ pH=7 B.ˮ�����ӻ�KW=c2(OH-) C.V=10 D.c(K+)<c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һ�°���ͼ���Ľ�����Ĵ����������գ��������̿ɼ�Ҫ��ʾ��ͼ�� 
����������ķ����������Ƽ���°��Ƽ�����Ƽ���°��Ƽ�����Ƶô����ͬʱ�����ɵõ�һ�ָ���Ʒ��
��1�������������з����Ļ�ѧ��Ӧ����ʽ�� �� ʵ���ҷ���������IJ����� �� �ò���ʹ�õIJ�����������
��2��д������������X���ʵķ���ʽ��
��3��ʹԭ���Ȼ��Ƶ������ʴ�70%��ߵ�90%���ϣ���Ҫ���������ѭ���������������еı��1��2����
��4��Ϊ�����Ʒ̼�������Ƿ����Ȼ��ƣ���ȡ������������ˮ����Ҫ���Լ�����
��5����ĸҺ��ͨ����������ϸСʳ�ο�������ȴ��������Ʒ��ͨ������������ ��
A.����NH4+��Ũ�ȣ�ʹNH4Cl���������
B.ʹNaHCO3���������
C.ʹNaHCO3ת��ΪNa2CO3 �� ���������NH4Cl���ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʵ�ʵ�鷽������ȷ���� �� ��
A. ��ȥCO2������HCl���壺ͨ������NaHCO3��Һ���ٸ�������
B. ��ȥNa2CO3����������NaHCO3�����������м���
C. ��ȥCl2�е�HCl���壺ͨ��NaOH��Һ
D. ��ȥFeCl3������Һ��������FeCl2��ͨ���Թ�����Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʴ��ÿ����ʴ����ʧ�ĸ���ռ���������������ķ�֮һ�����������������Ҫԭ������Ϊ���������ƹ����л���������̼���ʣ��ڳ�ʪ�Ŀ����������γ�ԭ��أ������绯ѧ��ʴ��
(1)�ڿ�����Ȳ���Ļ����У���������ӦʽΪ___________________
(2)���и������������FeƬ��ʴ�ɿ쵽����˳����___________������ű�ʾ����
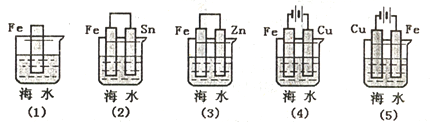
(3)��ͼװ�D��������ʢ�б���NH4NO3��֬��Һ���ܹ��������ݵ������Һ���γɱպϻ�·��
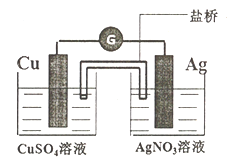
�ٸ�װ�õ�����ת����ʽΪ��_________��װ�ù���ʱ�������е�NH4+����___________��(��CuSO4��Һ����AgNO3��Һ��)
���������Ż���ͭ˿����·��Ҳ�е���ͨ������ͭ˿���Ϊ_________�����ü���ӦʽΪ��___________��
(4)����ԭ���ԭ�������ʵ����֤Cu2+��Fe3+�����Ե�ǿ��������ͼ�����ڻ���ʵ��װ��ͼ_____________��Ҫ�����һ�������ŵ�ԭ��أ�����缫���Ƽ��������Һ������ԭ���������Ӧʽ__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com