
某二元酸(H2A)在水中的电离方程式为H2A===H++HA-,HA- H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L
D.若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源:2015-2016学年青海西宁第四高级中学高二下期末化学卷(解析版) 题型:选择题
下列说法错误的是( )
A.同系物一定符合同一通式
B.同分异构体一定具有相同的最简式
C.相对分子质量相等的两种有机物必定是同分异构体
D.同分异构体间不一定有相似的化学性质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下学期期末考试化学卷(解析版) 题型:选择题
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
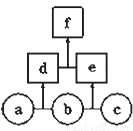
A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:选择题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
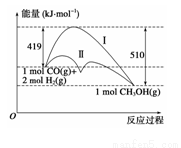
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:选择题
利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
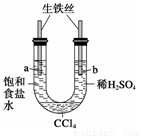
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高一下期末考试化学卷(解析版) 题型:选择题
下列说法正确的是 ( )
A. ⅠA族元素的金属性比ⅡA族元素的金属性强
B. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D. 第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高二下期末考化学卷(解析版) 题型:实验题
Na2CO3的制取方法及Na2CO3和NaHCO3综合实验探究
Ⅰ. (1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
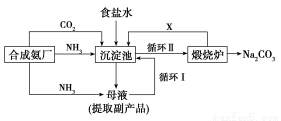
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是_______________________________________________。
②写出沉淀池中反应的化学方程式_______________________________________________。
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________________________________。
(3)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:_______________________。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO浓度较大,能与CaCl2发生反应:Ca2++CO===CaCO3↓ (离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳市高二下期末考化学卷(解析版) 题型:选择题
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI-淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com