
已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42—+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中,用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/LKMnO4溶液滴定.当滴入20.00mLKMnO4溶液时恰好完全反应.求该软锰矿中MnO2的质量分数.
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
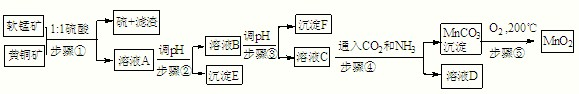
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
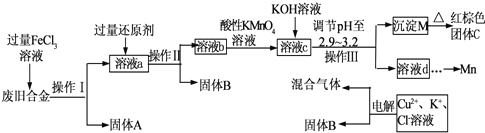
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
查看答案和解析>>
科目:高中化学 来源:黑龙江省哈九中2010-2011学年高一上学期期末考试化学试题 题型:038
将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后(已知KMnO4的分解率为x),收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,加热,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中.
(1)请配平下列方程式:

(2)在上式反应中若收集到3.36 L Cl2(标准状况下)时,转移电子的物质的量为________.
(3)a+b=________(用含x的表达式表示).
(4)当a+b=0.18时,残留固体的质量为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com