
在某温度下,A+B![]() 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,υ(正) ,
υ(逆) (“减慢”或“加快”),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增减B的量,平衡不发生移动,则B是 态。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知H2B在水溶液中存在以下电离:
已知H2B在水溶液中存在以下电离: H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2- H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
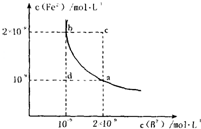
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2B在水溶液中存在以下电离:
![]()
![]() 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
的平衡常数表达式为KSP=c(Fe2+)·c(B2-),
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是( )
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三模拟考试(理综)化学部分 题型:选择题
在某温度下,向容积为2 L的恒容密闭容器中充入0.10 mol AB2和一定量的B2发生反应:2AB2(g)+B2(g) 2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
A.0.20 mol B.0.12 mol C.0.10 mol D.0.040 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com