
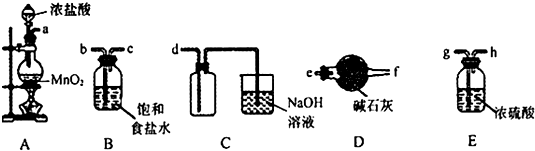
| A. | 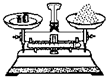 称取氢氧化钠 | B. |  浓硫酸稀释 | C. | 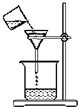 过滤溶液 | D. | 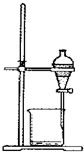 分液操作 |
分析 A.称量时左物右码,且NaOH具有腐蚀性,应在小烧杯中称量;
B.浓硫酸不能在量筒中稀释;
C.过滤需要引流;
D.分层的液体可利用分液漏斗分离.
解答 解:A.称量时左物右码,且NaOH具有腐蚀性,应在小烧杯中称量,则图中药品的位置、操作均不合理,故A错误;
B.浓硫酸不能在量筒中稀释,量筒只能量取液体,应在烧杯中稀释、并用玻璃棒不断搅拌,故B错误;
C.过滤需要引流,则图中缺少玻璃棒,故C错误;
D.分层的液体可利用分液漏斗分离,图中分液装置及操作合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、仪器的使用及混合物分离等为解答的关键,侧重分析与实验能力的考查,注意实验技能及实验装置的作用,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
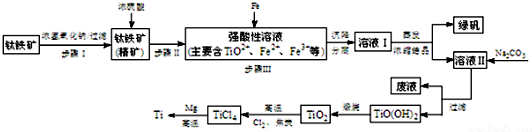
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
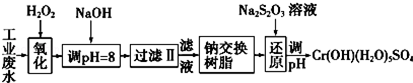
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
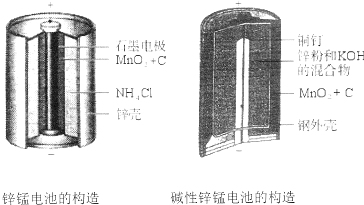
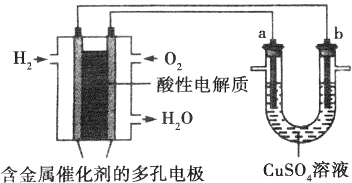
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com