
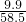 mol≈0.17mol,所以该溶液的物质的量浓度是:0.17 mol/L,
mol≈0.17mol,所以该溶液的物质的量浓度是:0.17 mol/L,

科目:高中化学 来源: 题型:
| 葡萄糖注射液 |
| 规格:250mL |
| 密度:1.08g?mL-1 |
| 生产批号:10032032 |
| 有效期:至2013年3月 |
| 质量分数:5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.查看答案和解析>>
科目:高中化学 来源:2008-2009学年浙江省东北三校高一(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com