

 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
. 分析 (1)由工艺流程可知,B2O3与氟化钙、硫酸反应生成BF3,反应还生成硫酸钙与水;
BF3分子的中心B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3;
(2)H3BO3中B原子含有空轨道,与氢氧根离子之间通过配位键形成[B(OH)4]-,则[Al( OH)4]-中Al也形成1个配位键;
NH4+中含有1个配位键,BF4-中含有1个配位键;
(3)每个B原子形成5个B-B键,每个B-B键为1个B原子提供$\frac{1}{2}$;
(4)a.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体;
b.两种晶体中的B-N键均为共价键;
c.六方相氮化硼层间作用力为范德华力;
d.立方相氮化硼中N原子与B原子之间形成单键;
②六方相氮化硼晶体的片状结构中没有自由电子;
(5)B为+3价,O为-2价,可知B3O6n-中n=3,结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,六元环中有3个B原子、3个O原子,B、O原子依次间隔连接,且每个B原子还连接1个不在六元环上的O原子.
解答 解:(1)由工艺流程可知,B2O3与氟化钙、硫酸反应生成BF3,反应还生成硫酸钙与水,反应方程式为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O,
BF3分子的中心B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3,B原子的杂化轨道类型为sp2,
故答案为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;sp2;
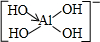
(2)H3BO3中B原子含有空轨道,与氢氧根离子之间通过配位键形成[B(OH)4]-,则[Al( OH)4]-中Al也形成1个配位键,[Al( OH)4]-的结构式为 ,
,
NH4+中含有1个配位键,BF4-中含有1个配位键,1molNH4BF4含有2mol配位键,即配位键数目为:2NA,
故答案为: ;2NA;
;2NA;
(3)每个B原子形成5个B-B键,每个B-B键为1个B原子提供$\frac{1}{2}$,含有B-B键数目为$\frac{12×5}{2}$=30,
故答案为:30;
(4)①a.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故a错误
b.两种晶体中的B-N键均为共价键,故b正确;
c.六方相氮化硼层间作用力为范德华力,所以质地软,故c正确;
d.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故d错误,
故选:ad;
②六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电,
故答案为:六方相氮化硼晶体的片状结构中没有自由电子;
(5)B为+3价,O为-2价,可知B3O6n-中n=3,结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,六元环中有3个B原子、3个O原子,B、O原子依次间隔连接,且每个B原子还连接1个不在六元环上的O原子,故结构式为: ,
,
故答案为: .
.
点评 本题是对物质结构与性质的考查,涉及陌生方程式书写、杂化方式判断、化学键、配合物、晶胞结构与计算、晶体类型与性质、微粒结构等,需要学生具备扎实的基础与灵活运用能力,掌握均摊法进行晶胞有关计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
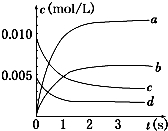 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
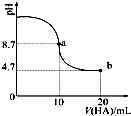 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
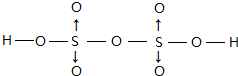 (配位键须注明).
(配位键须注明).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
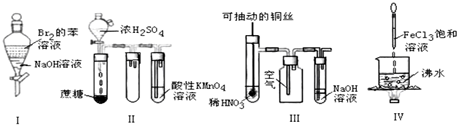
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
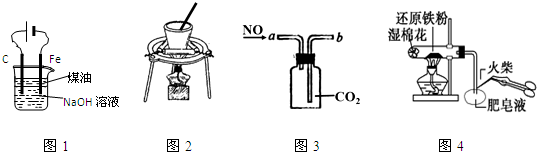
| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com