
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
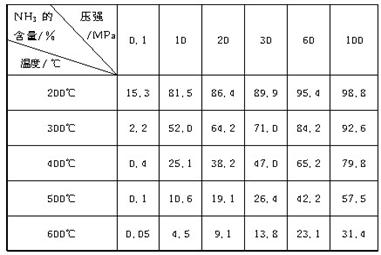
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(1)逆反应 放热 (2)C (3)41.77%
(4)加入过量的N2或及时从平衡体系中移走NH3
解析 根据表中的数据,当压强一定时,升温,NH3的含量减小,即平衡向逆反应方向移动,即正反应为放热反应;当温度一定时,增大压强,NH3的含量增大,即增大压强有利于平衡向正反应方向移动,故合成氨适宜的条件是低温高压。
(4)在500℃,30MPa时,NH3的含量为26.4%,设转化的N2体积为x,则有
N2(g) + 3H2(g)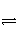
 2NH3(g)
2NH3(g)
起始体积 1 3 0
转化体积 x 3x 2x
平衡体积 1-x 3-3x 2x
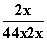 ×100%=26.4%,x=0.4177
×100%=26.4%,x=0.4177
则N2的转化率为41.77%。


科目:高中化学 来源: 题型:
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于水的离子积常数的叙述中,正确的是( )
A.因为水的离子积常数的表达式是KW=[H+][OH-],所以KW随溶液中H+和OH-浓度的变化而变化
B.水的离子积常数KW与水的电离平衡常数K是同一个物理量
C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化
D.水的离子积常数KW与水的电离平衡常数K是两个没有任何关系的物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。若反应前后压强不变,则反应后缩小的气体体积与原反应物体积的比值为( )
A.1∶5 B.1∶4 C.1∶3 D.1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12 mol3·L-3,Ksp[MgF2]=7.42×10-11 mol3·L-3。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的[Mg2+]大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,[Mg2+]增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后, Mg(OH)2不可能转化为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ag2SO4的Ksp为2.0×10-5 mol3·L-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO 浓度随时间变化关系如图所示[饱和Ag2SO4溶液中[Ag+]=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如图所示[饱和Ag2SO4溶液中[Ag+]=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO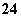 浓度随时间变化关系的是( )
浓度随时间变化关系的是( )
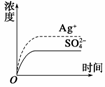
查看答案和解析>>
科目:高中化学 来源: 题型:
写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式
(1)Ba(OH)2:____________________________________________________________;
(2)Na2CO3: __________________________________________________________;
(3)KCl: ____________________________________________________________;
(4)AgNO3: ___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是双选) )。
A.在0.1 mol·L-1 NaHCO3溶液中:cNa+)>cHCO )>cCO
)>cCO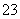 )>cH2CO3)
)>cH2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:cOH-)-cH+)=cHCO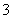 )+2cH2CO3)
)+2cH2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:cCO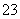 )>cHCO
)>cHCO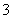 )>cOH-)>cH+)
)>cOH-)>cH+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,cNa+)=0.1mol·L-1]:cNa+)
=cCH3COO-)>cCH3COOH)>cH+)=cOH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com