

分析 SnCl2在盐酸中溶解,再加入锡粉,溶解得到SnCl2溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体,
(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取加热浓缩、冷却结晶、冷却结晶、过滤、洗涤得到;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(6)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算;
解答 解:SnCl2在盐酸中溶解,再加入锡粉,溶解得到SnCl2溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体,
(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(6)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7计算.
119g $\frac{1}{3}$mol
1.19g×x 0.100mol/L×0.025L
故$\frac{119g}{1.19g×x}$=$\frac{\frac{1}{3}mol}{0.100mol/L×0.025L}$
解得x=75.00%,
故答案为:75.00%.
点评 本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写、滴定应用及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.


科目:高中化学 来源: 题型:解答题
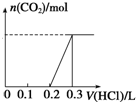 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m+4.8)g | B. | (m+5.1)g | C. | (m+10.2)g | D. | (m+19.2)g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水长期放置后会呈现浅黄绿色 | |
| B. | 长期放置的氯水也能使有色布条褪色 | |
| C. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| D. | 用氯气制漂白粉是为了得到易贮存的漂白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com