
| ʵ����� | ʵ������ | ʵ���� |
| �� | ��AgNO3��Һ | �а�ɫ�������� |
| �� | ������NaOH��Һ������ | �ռ�������1.12L����״���� |
| �� | ������BaCl2��Һʱ�������ó�������ϴ�ӡ������������������м�������ϡ���ᣬȻ�������� | ��һ�γ�������Ϊ6.27g���ڶ��γ�������Ϊ2.33g |
| �����ӷ��� | ���ʵ���Ũ��/mol•L-1 |
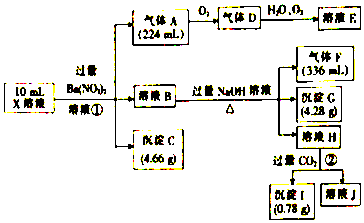
���� ����̼���������������Ȼ������ǰ�ɫ���������ʵ��1��ȷ���Ƿ��������Ӳ���ȷ��������ʵ��2��֪��������ӣ�����ʵ��3��֪����һ����̼�ᱵ�����ᱵ������Һ��һ������CO32-��SO42-������Һ��һ������Ba2+��Mg2+��
�ڼ�����NaOH��Һ�����ȣ����ռ������壬�������Ϊ�����������ݱ���°�����������Լ���笠������ʵ�����
��̼�ᱵ���������ᣬ���ᱵ���������ᣬ��˼��������ʣ��2.33g����ΪBaSO4��������̼�غ㼴���������Һ��c��SO42-����c��CO32-����
������Ϸ����Լ����и��������ݿ�֪����Һ�п϶����ڵ�������NH4+��CO32-��SO42-�������㣬NH4+�����ʵ���Ϊ0.05 mol��CO32-��SO42-�����ʵ����ֱ�Ϊ0.02 mol��0.01 mol�����ݵ���غ��K+һ�����ڣ��Դ������
��� �⣺��1��̼���������������Ȼ������ǰ�ɫ���������ʵ��1�õ�������ȷ�����Ȼ�������ʵ��1��Cl-�Ƿ���ڵ��ж��ǣ�����ȷ��������ʵ��2��֪��������ӣ�����ʵ��3��֪����һ����̼�ᱵ�����ᱵ������Һ��һ������CO32-��SO42-��̼�ᱵ��̼��þ�����ᱵ�ȶ��Dz�����ˮ�ij������ʿ���֪��Һһ�������ڵ������ǣ�Ba2+��Mg2+��
�ʴ�Ϊ������ȷ����Ba2+��Mg2+��
��2����ϣ�1���з�����֪��Һ��һ�����е�������ΪCO32-��SO42-����̼�ᱵ���������ᣬ���ᱵ�������������֪���������ʣ��2.33g����ΪBaSO4���������غ��֪��Һ��c��SO42-��=$\frac{\frac{2.33g}{233g/mol}}{0.1L}$=0.1mol/L��6.27g������̼�ᱵ������Ϊ6.27g-2.33g=3.94g������̼�غ��֪��Һ��c��CO32-��=$\frac{\frac{3.94g}{197g/mol}}{0.1L}$=0.2mol/L��
�ʴ�Ϊ��
| �����ӷ��� | ���ʵ���Ũ��/mol•L-1 |
| SO42- | 0.1 |
| CO32- | 0.2 |
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬���ճ�������֮��Ĺ����롢����Ϊ���Ĺؼ������ط����������ƶ������Ŀ��飬ע�����غ��Ӧ�ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú�ĸ����ǻ�ѧ�仯����ú��������Һ���������仯 | |
| B�� | ʯ���ѽ���Ϊ�˻�ø������ͣ�������Ѹ��������������Ҫ | |
| C�� | ���ܡ����ܡ����ܶ�����������Ⱦ����ɫ����Դ������ȫʹ�� | |
| D�� | �����ǽ�ʯ��ʯ�����ʯӢ�ڲ�����¯�и��������Ƶõ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ���ǻ�ԭ�� | B�� | O2�������� | C�� | H2����������Ӧ | D�� | O2����ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 14g��N2��13C2H2��ɵĻ���������ĵ�����Ϊ7NA | |
| B�� | ��״���£�11.2L NO��11.2L O2��Ϻ������ķ�����С��0.75NA | |
| C�� | �����£�1L PH=3��Al2��SO4��3��Һ�У�ˮ�������H+��ĿΪ10-3NA | |
| D�� | ��100mL 1 mol•L-5 Na2S02��Һ��1.12 L����״����CL2�ķ�Ӧ�У�•��ԭ��ʧ����0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | D��C��B��A | B�� | B��C��D��A | C�� | D��B��C��A | D�� | C��D��A��B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 | Fe��OH��3 |
| Ksp | 4.96��10-9 | 6.82��10-6 | 4.68��10-6 | 5.61��10-12 | 2.64��10-39 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ������믣�XeF6�� | B�� | �����ᣨHClO�� | C�� | �Ȼ���S2Cl2�� | D�� | ���ף�P4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú��������Һ���Ǹ�Ч����������ú̿����Ҫ;�� | |
| B�� | ��˿����Ҫ�ɷ�����ά�� | |
| C�� | pHС��7.0�Ľ���ͨ����Ϊ���� | |
| D�� | ���ϳ�ϴ�Ӽ����ڱ�ϸ���ֽ⣬�ʲ��ᵼ��ˮ��Ⱦ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com