
分析 B的次外层电子数为2,B的最高价为+4,即最外层有4个电子,推出B为碳元素,C、D次外层电子数为8,最高正价分别为+5,+7,可得C为P,D为Cl,BCDA原子序数依次增大,A原子的核外电子数不超过20,且A的最高价为+1,推出A为K元素.
解答 解:(1)B的次外层电子数为2,B的最高价为+4,即最外层有4个电子,推出B为碳元素,C、D次外层电子数为8,最高正价分别为+5,+7,可得C为P,D为Cl,BCDA原子序数依次增大,A原子的核外电子数不超过20,且A的最高价为+1,推出A为K元素,
故答案为:K;C;P;Cl;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层数越多原子半径越大,故原子半径:K>P>Cl>C,
故答案为:K>P>Cl>C;
(3)C(磷)所在的主族元素的氢化物沸点最高的是NH3,因为氨气分子之间形成氢键,
故答案为:NH3;
(4)B(碳)的最高价氧化物的为:CO2,故答案为:CO2;
(5)溶液中KOH物质的量为0.2L×1mol/L=0.2mol,二氧化碳物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,由于1:2<n(CO2):n(KOH)=3:4<1:1,故反应生成K2CO3、KHCO3,令K2CO3、KHCO3物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.15}\\{2x+y=0.2}\end{array}\right.$,解得x=0.05,y=0.1,
故答案为:n(K2CO3)=0.05mol,n(KHCO3)=0.1mol.
点评 本题考查结构性质位置关系应用,关键是利用核外电子排布与化合价推断元素,注意氢键对物质性质的影响,(5)中注意判断产物,结合守恒法计算解答.


科目:高中化学 来源: 题型:选择题
| A. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| B. | 含有SCN-离子的溶液中:Ca2+、Fe2+、NO3-、Cl- | |
| C. | 水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于1.06 g | B. | 大于1.06 g而小于2.86 g | ||
| C. | 等于2.86 g | D. | 大于2.86 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
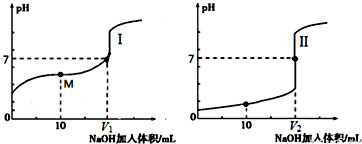
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  稀H2SO4Cu-Zn原电池 | |
| B. |  CuSO4粗铜的精炼 | |
| C. | 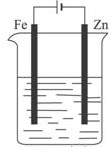 ZnCl2溶液铁片镀锌 | |
| D. | 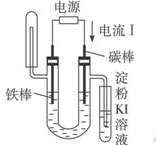 饱和氯化钠溶液验证NaCl溶液(含酚酞)电解产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| C. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com