
| A. | 是银白色、质软的金属 | |
| B. | 阳离子氧化性比铝离子强 | |
| C. | 加热蒸干TiCl3溶液可得到无水TiCl3 | |
| D. | 与稀硝酸作用生成硝酸盐 |
科目:高中化学 来源: 题型:多选题
| A. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,与水反应产物不完全相同 | |
| B. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有离子键 | |
| D. | 由Y和T组成的物质YT是,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
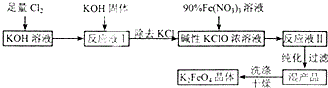 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
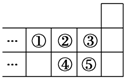
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com