
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氮原子2p能级半充满,所以比较稳定,难以失去电子;
B.CO2分子是直线型,杂化类型为SP杂化,分子构型与键的极性无关;
C.金刚石是原子晶体;
D.从HF分子中含有氢键角度分析.
解答 解:A.氮原子2p能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A错误;
B.理论解释不对,CO2分子的价层电子对是2,根据价层电子对互斥理论,键角为180°,CO2分子是直线型,故B正确;
C.金刚石是原子晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D错误.
故选B.
点评 本题考查物质结构与性质知识,难度不大,注意CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子极性键形成的直线型分子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
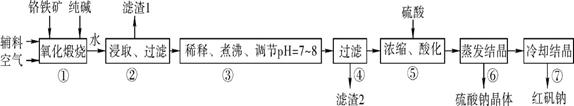
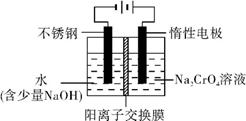
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol气态H2与1mol气态氧气完全燃烧生成2mol液态水时放出571.6 kJ的热量 | |
| B. | 1mol气态H2与0.5mol气态氧气完全燃烧生成1mol液态水时吸收285.8kJ的热量 | |
| C. | 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热量 | |
| D. | 上述热化学方程式可表示为H2(g)+O2(g)=H2O(1),H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2因导电能力强而用于制造通讯光缆 | |
| B. | 用秸秆中的纤维素直接水解制取燃料乙醇 | |
| C. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 | |
| D. | 硅胶可作袋装食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
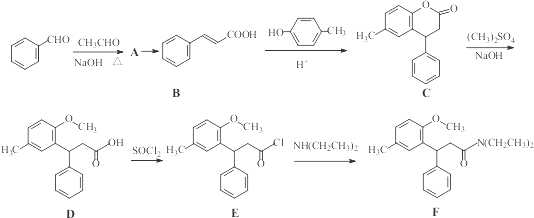
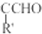
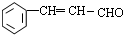 .
.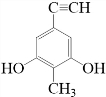 等.(任写一种)
等.(任写一种)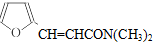 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
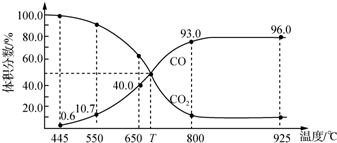
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com