
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
分析 (1)根据物质的组成和熔点可知A组属于原子晶体,B组属于金属晶体,C组形成分子晶体,D组是离子晶体;
(2)由于HF中存在氢键,导致HF的沸点比其它氢化物的沸点高;
(3)D组物质为离子晶体,根据离子晶体的性质判断.
解答 解:(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键;
故答案为:原子;共价键;
(2)N、O、F元素的电负性较强,对应的氢化物或含氢化合物可形成氢键,由于HF中存在氢键,导致HF的沸点比其它氢化物的沸点高,
故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;
(3)D组物质为离子晶体,有硬度大,但不是非常高,水溶液能导电、固体不能导电而熔融状态能导电的性质,
故答案为:②④.
点评 本题考查晶体的性质,通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常,题目难度不大.


科目:高中化学 来源: 题型:解答题
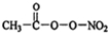 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 1mol A从酸中置换 H+生成的H2比 1mol B从酸中置换H+生成的H2多 | |
| D. | A金属可以把B金属从其盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com