
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
分析 浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应,生成气体Z,4s后,X2、Y2、Z的浓度分别是0.4mol•L-1、0.8mol•L-1、0.4mol•L-1,则参加反应的c(X2)=(1-0.4)mol/L=0.6mol/L、c(Y2)=(1-0.8)mol/L=0.2mol/L、c(Z)=(0.4-0)mol/L=0.4mol/L,同一反应中同一时间段内各物质的物质的量浓度变化量之比等于其计量数之比,再结合原子守恒确定Z的分子组成,据此分析解答.
解答 解:浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应,生成气体Z,4s后,X2、Y2、Z的浓度分别是0.4mol•L-1、0.8mol•L-1、0.4mol•L-1,则参加反应的c(X2)=(1-0.4)mol/L=0.6mol/L、c(Y2)=(1-0.8)mol/L=0.2mol/L、c(Z)=(0.4-0)mol/L=0.4mol/L,同一反应中同一时间段内各物质的物质的量浓度变化量之比等于其计量数之比,所以X2、Y2、Z的计量数之比=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,
所以其方程式为3X2+Y2═2Z,再结合原子守恒确定Z的分子组成为X3Y,所以其方程式为3X2+Y2═2X3Y,
故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确同一反应同一时间段各物质的浓度变化量之比与计量数的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | S2Cl2的结构简式:S-Cl-S-Cl | |
| B. | 13.5g S2Cl2和NaOH反应电子转移数为0.1NA | |
| C. | S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 | |
| D. | S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2;△H(298K)=-242kJmol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H(298K)=+484kJmol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-242kJmol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-484kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物:SO2 Mn2O7 NO | |
| B. | 碱性氧化物:Na2O Na2O2 Al2O3 | |
| C. | 盐:Na2CO3 AlCl3 AgCl | |
| D. | 电解质:SO3 Na2O BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

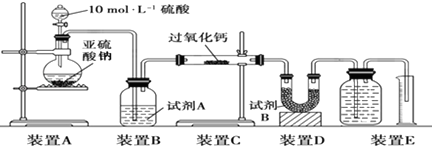
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
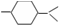 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子;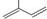 ;
;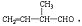 所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.
所含官能团的名称是碳碳双键、醛基;该有机物发生加成反应后,所得产物的结构简式为CH3CH2CH(CH3)CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和OH-向阳极定向运动,Cl-被电解,而OH-留在阳极,因此阳极区显碱性 | |
| B. | 阴极的电极反应是:4OH--4e-═O2↑+2H2O | |
| C. | 电解槽内总反应方程式为:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| D. | 向阴阳极分别滴入2滴酚酞,现象是阴极区变成红色,阳极区不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用氮气和氢气合成氨气 | B. | 一氧化氮与氧气反应生成二氧化氮 | ||
| C. | 氨气经催化氧化生成一氧化氮 | D. | 由氨气制碳酸氢氨和硫酸氨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com