
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 正戊烷的熔沸点比异戊烷的高 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
科目:高中化学 来源: 题型:选择题
| A. | 用聚光手电筒照射,产生丁达尔效应 | |
| B. | 加入碘水,溶液变蓝 | |
| C. | 加入稀硫酸振荡并加热,再加入新制Cu(OH)2悬浊液,有红色沉淀生成 | |
| D. | 加入碘化钾溶液后,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
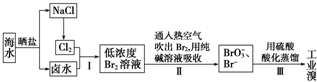
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
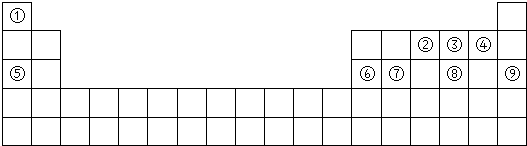
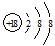
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
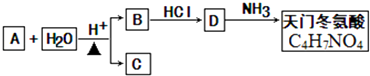
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
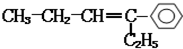 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数量最多为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,10 | B. | 4,3,12 | C. | 4,2,7 | D. | 4,5,10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
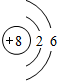 ,B的离子结构示意图
,B的离子结构示意图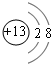 ,D的单质分子的电子式
,D的单质分子的电子式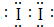 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在常温下不能与氧气反应 | |
| B. | 铝合金的强度和硬度都比纯铝的大 | |
| C. | 足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 | |
| D. | 铝在常温下不能与冷的浓硫酸和浓硝酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com