
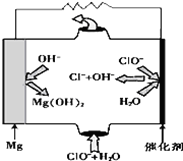
 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
分析 该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,放电时,电解质溶液中阴离子向负极移动,据此进行解答.
解答 解:A.镁失电子发生氧化反应作负极,故A错误;
B.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,故B正确;
C.正极上双氧水得电子发生还原反应,电极反应式为:ClO-+H2O+2e-═Cl-+2OH-,则正极生成氢氧根离子,溶液的pH不断增大,故C错误;
D.放电过程中氢氧根离子向负极移动,故D错误;
故选B.
点评 本题考查了原电池原理,题目难度中等,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,试题培养了学生的分析、理解能力及灵活应用能力.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O
+H2O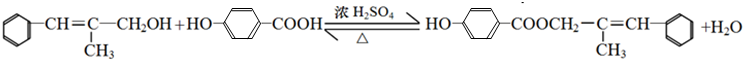
 .
.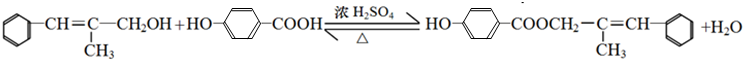
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色气体,难溶于水,密度比空气略小 | |
| B. | 乙烯燃烧时,火焰明亮,同时产生黑烟 | |
| C. | 与溴水发生取代反应而使溴水褪色 | |
| D. | 乙烯的产量标志着一个国家的石油化工水平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com