
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | Na2O2和Na2O均可常用作呼吸面具中的供氧剂 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,是因为熬制过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃”柔铁为蒸干,不尔则多断折”,剂钢是指铁合金 |
分析 A.根据食盐的性质进行分析;
B.过氧化钠与水、二氧化碳反应生成氧气,氧化钠与水、二氧化碳反应不生成氧气;
C.铁置换铜属于湿法炼铜;
D.合金的硬度大于其任一成分;
解答 解:A.食盐腌制食品,食盐进入食品内液产生浓度差,形成细菌不易生长的环境,可作防腐剂,食盐具有咸味,所以食盐可作调味剂,也可作食品防腐剂,故A正确;
B.Na2O2常用作呼吸面具中的供氧剂,氧化钠不具有此用途,故B错误;
C.“熬胆矾铁釜,久之亦化为铜”铁置换铜属于湿法炼铜,该过程发生了置换反应,故C正确;
D.剑刃硬度要大,所以用碳铁合金,故D正确;
故选:B.
点评 本题考查物质性质、物质成分、物质变化等知识点,为高频考点,明确物质组成、性质、用途关系是解本题关键,会根据物质性质解释其用途,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
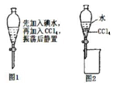
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替四氯化碳 | |
| B. | 进行如图1操作后,实验现象为液体分层,下层呈无色 | |
| C. | 利用如图2装置可以分离四氯化碳和水 | |
| D. | 在这个操作中,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| B. | 用催化剂能提高反应物的平衡转化率 | |
| C. | 平衡时其他条件不变,升高温度能提高COCl2的转化率 | |
| D. | 当反应达平衡时,恒温恒压条件下通入Ar能提高COCl2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸发结晶时应将溶液完全蒸干 | |
| D. | 洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标况下,22.4LSO3和22.4LC2H4原子个数比为2:3 | |
| B. | 将78gNa2O2与过量CO2反应转移的电子数为2NA | |
| C. | 28g乙烯分子中含有极性共价键的数目为6NA | |
| D. | 1molNaCl晶体中含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为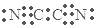 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
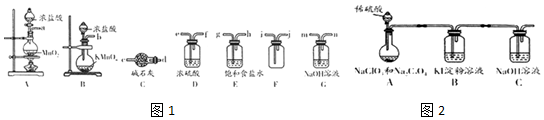
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com