
下列反应与Na2O2+SO2—→Na2SO4相比较,Na2O2的作用相同的是( )
A.2Na2O2+2CO2—→2Na2CO3+O2
B.2Na2O2+2SO3—→2Na2SO4+O2
C.Na2O2+H2SO4—→Na2SO4+H2O2
D.3Na2O2+Cr2O3—→2Na2CrO4+Na2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)化合物既可分为酸、碱、盐、氧化物,又可分为电解质和非电解质( )
(2)非金属氧化物不一定是酸性氧化物,但酸性氧化物一定是非金属氧化物( )
(3)Al2O3可与盐酸和氢氧化钠反应,SiO2可与氢氟酸和氢氧化钠反应,因而二者均属于两性氧化物( )
(4)KHCO3的水溶溶呈碱性,是碱式盐;NaHSO4的水溶液呈酸性,是酸式盐( )
(5)Na2O2、SO2、CH3COOH等为共价化合物;H2SO4、NaOH、Na2CO3等为离子化合物( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中 正确的是(
正确的是( )
)
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,
又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原溶液中Na2CO3的物质
的量之比为1:2
C.等质量的NaHCO3和Na2 CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同
CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3 结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,则该盐不可能是( )
A.FeC13 B.NaC1 C.KNO3 D.Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为 。
(2)装置B所盛的试剂是 ,其作用是 。
(3)装置C所盛试剂是 ,C 中反应的离子方程式是 。
(4)由此得到结论,酸性 : > >
查看答案和解析>>
科目:高中化学 来源: 题型:
部分被氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
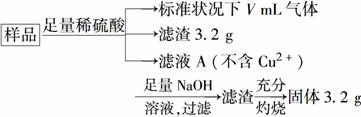
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中铁元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
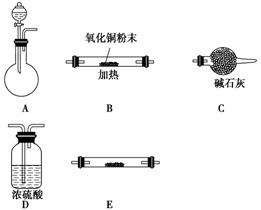
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
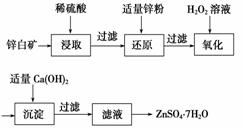
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
在 某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com