
【题目】室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
【答案】0.01 0.4
【解析】
(1)盐酸和硫酸的混合溶液中加入过量BaCl2溶液,发生反应SO42-+Ba2+=BaSO4↓,利用硫酸根离子守恒计算硫酸的物质的量,每份溶液中n(H2SO4)=n(BaSO4)=2.33g÷ 233g·mol-1=0.01mol;
(2)另一份混合溶液中加入50mL 1.0 mol·L-1NaOH溶液,发生的反应是H2SO4+2NaOH=Na2SO4+2H2O,HCl+NaOH=NaCl+H2O,充分反应后溶液的c(OH-)=0.1mol·L-1(溶液的体积为100mL),则消耗的氢氧根为0.05L×1.0 mol·L-1-0.1L×0.1 mol·L-1=0.04mol,根据方程式H2SO4+2NaOH=Na2SO4+2H2O可知,0.01mol硫酸反应消耗氢氧化钠的物质的量为0.01mol×2=0.02mol,故与盐酸反应氢氧化钠的物质的量为:0.04mol-0.02mol=0.02mol,由方程式HCl+NaOH=NaCl+H2O可知,n(HCl)=n(NaOH)=0.02mol,故盐酸的物质的量浓度为:c(HCl)=![]() =0.02mol×2÷0.1L=0.4mol/L。
=0.02mol×2÷0.1L=0.4mol/L。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】工业上用木炭粉和水蒸气在高温条件下反应制取H2,同时生成CO2。某学习小组在实 验室中模拟H2的工业生产过程并测定其产率,实验装置如下所示。

(1)仪器a的名称为_______________。仪器b的作用为____________________________。
(2)实验步骤:连接好装置,检查装置的气密性;______________________(按顺序填入下列步骤的序号)。
①向装置A、B、C、D中分别加入相应试剂,打开活塞K,通入一段时间N2。
②加热装置B处硬质玻璃管。
③关闭活塞K,连接盛有适量水的量气管。
④点燃装置A处酒精灯。
⑤待装置B处木炭粉完全反应后,停止加热。
(3)装置B处硬质玻璃管中发生的所有反应的化学方程式为______________________。
(4)读取B气管读数时,应注意的事项为冷却至室温、___________、视线与凹液面最低点相切;若仰视读取初始读数,则导致所测气体的体积___________(填“偏大”或“偏小”)。
(5)实验后所域取的气体体积为V2 mL标准状况);取装置C中液体,加入足量BaCl2溶液,过滤、洗涤,将滤液和洗涤液合并,以甲基橙为指示剂,用0.1000molL-1的盐酸标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V3mL。
①达到滴定终点时的现象为____________________________________________。
②H2的产率为______________________(列出代数式即可)。
③还可通过___________,得出装置C中所吸收产物的物质的量。
(6)从安全角度考虑,该实验装置的缺陷为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
Ⅰ.“氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为M(s)+xH2═MH2x(s) △H<0(M表示某种合金)。图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

下列说法中正确的是___(填字母代号)。
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M作还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
①850℃时反应达到平衡,x应满足的条件是_____。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是____(填字母代号)。
a.选用更高效的催化剂
b.升高温度
c.及时分离出氢气
d.增加氢气的浓度
Ⅱ.CO2是合成尿素的原料。
现以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体。装置丙中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
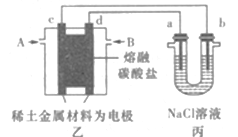
(1)工作过程中,装置乙中电极c为____(填电极名称)极。
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=____(忽略电解前后溶液体积变化,不考虑气体的溶解)。
Ⅲ.氨是制备尿素的原料。NH3、N2O4等在工农业生产、航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生产水和一种空气组成成分的单质。已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
(2)氨气溶于水得到氨水,在25℃下,将amol·L-1的氨水和bmol·L-1的硫酸溶液以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3·H2O的电离平衡常数:___________。
(3)用氨水除去SO2,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中离子浓度从大到小的关系是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,用化学用语回答下列有关问题。

(1)其中属于阴离子的是_____;
(2)其中化学性质最稳定的是_____;
(3)已知A元素的某种核素的中子数为18,该核素的符号是_____;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该元素的离子结构示意图为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A. 78B. 140C. 156D. 172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某种酶生物燃料电池的工作原理示意图。下列说法中不正确的是
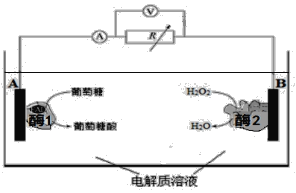
A. 葡萄糖是还原剂
B. 外电路中电子由A极移向B极
C. 溶液中H+ 由B极区移向A极区
D. B极电极反应式为:H2O2 +2H++2e-=== 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:

①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将a mol PCl5通入一个容积不变的密闭容器中,发生反应: PCl5(g) ![]() PCl3(g)+Cl2(g),平衡时测得混合气体的压强为P1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为P2,下列判断正确的是( )
PCl3(g)+Cl2(g),平衡时测得混合气体的压强为P1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为P2,下列判断正确的是( )
A. 2P1>P2 B. P1>P2
C. PCl5的转化率增大 D. Cl2的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com