

 .
. 分析 根据元素在周期表中的位置知,①-⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等.
解答 解:根据元素在周期表中的位置知,①-⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Na、Al原子有3个电子层,O原子有2个电子层,且Al原子序数大于Na,所以④、⑤、⑥的原子半径由大到小的顺序为⑤、⑥、④,故答案为:⑤、⑥、④;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强,③、⑦、⑧非金属性强弱顺序是⑧、③、⑦,所以其最高价氧化物的水化物酸性强弱顺序是,故答案为:⑧、③、⑦;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等,NaOH的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表和元素周期律综合应用,明确元素周期表结构、物质结构及原子结构是解本题关键,知道非金属性强弱判断方法,知道非金属性强弱与其最高价氧化物的水化物酸性关系,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
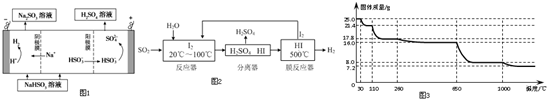
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
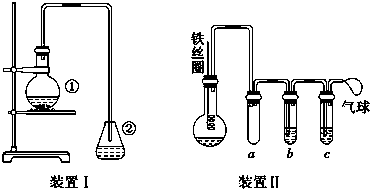
 .
.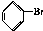 与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.
与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
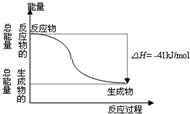 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com