

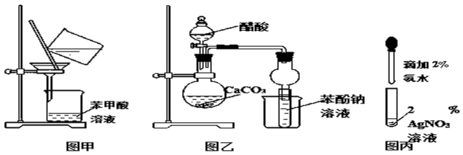
分析 由实验装置和实验目的可知,A中发生Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;B中品红褪色可检验生成气体,C为尾气处理,E中发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,D中品红检验氯气,
(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,用E制备氯气,用A制备二氧化硫;
(2)二氧化硫的漂白性是利用二氧化硫和有色物质化合生成不稳定无色物质,加热溶液时能重新变成红色,次氯酸的漂白性是利用次氯酸的强氧化性,加热褪色后的溶液不能回复红色;
(3)二氧化硫、氯气均有毒,直接排放会污染空气;
(4)二氧化硫与水化合得到亚硫酸,具有酸的通性,二氧化硫不能漂白酸碱指示剂;
(5)SO2与Cl2以体积比1:1混合后通入水中,恰好发生:SO2+Cl2+2H2O=H2SO4+2HCl.
解答 解:(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,为固体与液体反应需要加热的装置,选择E制备氯气,生成氯气体现盐酸的还原性,生成氯化锰体现盐酸的酸性,
故答案为:E;还原性;酸性;
(2)B装置中二氧化硫和有色物质化合生成不稳定无色物质,使品红溶液红色褪去,再加热B中褪色后溶液时,又变为红色,而D中褪色后加热无变化,
故答案为:D;
(3)二氧化硫、氯气均有毒,直接排放会污染空气,装置C的作用是:吸收多余的SO2和Cl2,
故答案为:吸收多余的SO2和Cl2;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,氯气与水反应生成盐酸、HClO,则出现的现象是先变红,后褪色,
故答案为:先变红,后褪色;
(5)SO2与Cl2以体积比1:1混合后通入水中,恰好发生:SO2+Cl2+2H2O=H2SO4+2HCl,没有气体剩余,没有漂白性,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查物质的性质实验,为高频考点,把握物质的性质、实验装置的作用、元素化合物知识、实验技能为解答的关键,侧重分析与实验能力的考查,注意气体的制备实验与性质实验的结合,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.05mol/L | C. | 0.4mol/L | D. | 0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “人造太阳”核心组件之一为高纯铍,可通过H2还原BeO制铍 | |
| B. | 富脂食品包装时,放入活性铁粉等抗氧剂,以防止油脂氧化变质 | |
| C. | 煤气化直接制烯烃研究取得重大突破,煤汽化可同时获得焦炭 | |
| D. | 俄罗斯发生了严重的假酒事件,假酒中的甲醇与乙二醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
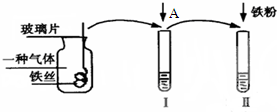 如图是某次实验探究铁及其化合物性质的流程图:
如图是某次实验探究铁及其化合物性质的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 16g O2中所含的氧原子数为NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com