
【题目】氯酸锶[Sr(ClO3)2]用于制造红色烟火。将氯气通入温热的氢氧化锶溶液制得氯酸锶的实验装置如下。已知氢氧化锶[Sr(OH)2]易与盐酸反应,水中存在Cl﹣时,不影响HCl的溶解,但会抑制Cl2的溶解。回答下列问题

(1)Sr(ClO3)2中Cl元素的化合价是_____,装置A中浓盐酸在反应中的作用是_____
(2)Y是_____(填字母),其作用原理是_____
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____
(4)装置C中三颈烧瓶内发生的反应为6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,转移5mol电子时生成Sr(ClO3)2的质量是_____
【答案】+5 还原性和酸性 B 氯气溶于水达到化学反应平衡:Cl2+H2OH++Cl﹣+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度 吸收氯气 127.5g
【解析】
A中浓盐酸和二氧化锰在加热条件下反应生成氯气,B用于除去氯气中的氯化氢,可用饱和食盐水,在C中发生6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,以制备氯酸锶,D为尾气处理装置,避免污染空气。
(1)Sr(ClO3)2中Sr为+2价,O为﹣2价,由化合价代数和为0可知Cl元素的化合价是+5价,装置A中生成氯气,盐酸被氧化,同时生成氯化锰,浓盐酸在反应中的作用是还原性和酸性的作用,故答案为:+5;还原性和酸性;
(2)Y用于除去氯气中的氯化氢,应为饱和食盐水,氯气溶于水,与水反应生成HCl和HClO,溶液中存在化学反应平衡:Cl2+H2OH++Cl﹣+HClO,饱和食盐水中氯离子浓度较大,根据平衡移动原理,增大氯离子浓度,该化学平衡逆向移动,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度,所以可以用饱和食盐水收集氯气,故答案为:B;氯气溶于水达到化学反应平衡:Cl2+H2OH++Cl﹣+HClO,根据平衡移动原理,增大氯离子浓度,抑制了氯气溶解生成盐酸和次氯酸,降低了Cl2溶解度;
(3)氢氧化钠和氯气反应,可避免氯气污染环境,则装置D中NaOH溶液的作用是吸收氯气,避免污染环境,故答案为:吸收氯气;
(4)装置C中三颈烧瓶内发生的反应为6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,反应中只有Cl元素化合价变化,Cl元素化合价由0价分别变为+5价、﹣1价,生成1molSr(ClO3)2,转移10mol电子,则转移5mol电子时生成Sr(ClO3)20.5mol,质量是0.5mol×255g/mol=127.5g,故答案为:127.5g。


科目:高中化学 来源: 题型:
【题目】海水化学资源的利用具有非常广阔的前景。以海水为原料制备MgCl2和NaOH的工艺流程如下:
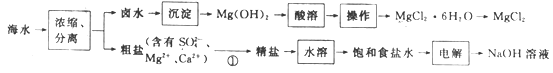
下列说法错误的是
A.“沉淀”时常用石灰乳作为沉淀剂
B.“酸溶”时加入过量盐酸,有利于得到MgCl2·6H2O晶体
C.“电解”时,NaOH在阴极区得到
D.过程①加入试剂的顺序依次为Na2CO3溶液、NaOH溶液、BaCl2溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是
A. 一定含有Al,其质量为4.5g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2和FeCl2
D. 一定含有(NH4)2SO4和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氯气,并对氯气的性质进行探究。
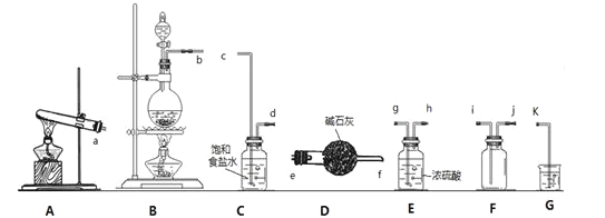
(1)写出实验室制氯气的化学方程式:__。欲制取并收集一瓶于燥的氯气,则“制取→收集”的实验装置连接顺序为__→c→d→__→i→j→k。
(2)装置C中饱和食盐水的作用是___。
(3)该小组同学对氯气性质进行如下探究:
实验步聚 | 实验结论 |
①将氯气通入NaCl溶液中,再加入1mLCCl4振荡,静置,观察四氢化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②将氯气通入KBr溶流中,再加入1mLCCl4振落,静置,观察四氯化碳层颜色 | |
③将氯气通入KI溶液中,再加入1mLCCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___,改进的办法是__。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为:___。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,分别将充满下列气体的容器倒扣于水槽中(设气体不发生扩散),充分反应后,瓶内溶液的物质的量浓度不等于![]() molL﹣1(约0.045molL﹣1)的是( )
molL﹣1(约0.045molL﹣1)的是( )
A.HClB.NO2、O2C.SO2、N2D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N-N吸收193 kJ热量,生成1 mol N≡N放出941 kJ热量。根据以上信息和数据,下列说法正确的是( )
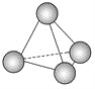
A. N4属于一种新型的化合物
B. N4是N2的同位素
C. N4转变为N2是物理变化
D. 1 mol N4气体转变为N2放出724 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应M+3N![]() 2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是
2Q(g),平衡时Q的体积分数与温度和压强的关系如图所示,下列判断正确的是
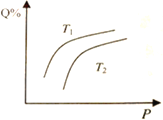
A. M和N不能都为气体
B. 由上图可知, N一定为气体
C. 若正反应方向ΔH>0,则T1<T2
D. 其它条件不变,压强增大,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________。
(2)由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,则c(K+)为________。
(3)相同物质的量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3∶2∶1时,消耗三种盐溶液的体积比为________。
(4)某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水的物质的量浓度可表示为________ mol/L;氨水的质量分数为________。
(5)已知1.505×1023个X气体分子的质量是8 g,则X气体的摩尔质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com