
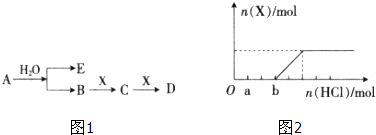
| 2mol×78g/mol |
| 7.8g |
| 2.5×10-9 |
| 0.5 |
| 1 |
| 2 |
| 1.0×10-10 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
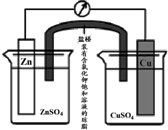
| A、在外电路中,电流从Zn极流向Cu极 |
| B、盐桥中的Cl-移向CuSO4溶液 |
| C、当负极减小65g时,正极增加65g |
| D、电池的总反应为 Zn+Cu2+=Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
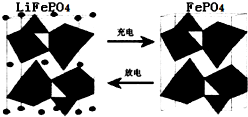
查看答案和解析>>
科目:高中化学 来源: 题型:
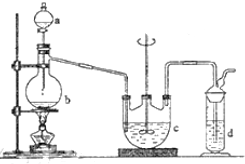 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
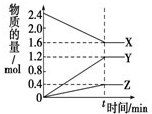
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
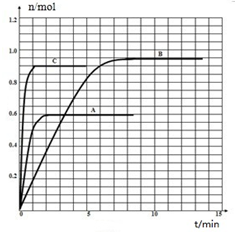
查看答案和解析>>
科目:高中化学 来源: 题型:
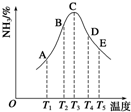 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铜粉,v(H2)增大 |
| B、加入NaCl固体,会增大Cl-浓度,从而使v(H2)增大 |
| C、加入NaHSO4固体v(H2)不变 |
| D、加入水,锌不与水反应,v(H2)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com