
| A. | 缺维生素A易患夜盲症 | B. | 缺铁易患白血病 | ||
| C. | 缺维生素C易患坏血病 | D. | 缺维生素D易患佝偻病 |
分析 A.缺乏易患夜盲症、皮肤干燥、干眼症;
B.缺铁易患缺铁性贫血;
C.缺乏维生素C易患坏血病;
D.维生素D促进钙、磷吸收和骨骼发育.
解答 解:A.维生素A促进人体正常发育,增强抵抗力,维持人的正常视觉,缺乏易患夜盲症、皮肤干燥、干眼症,故A错误;
B.铁是血红蛋白的组成元素,缺铁易患缺铁性贫血,故B正确;
C.维生素C维持正常的新陈代谢、维持骨肌肉和血液的正常生理作用,增长抵抗力,缺维生素C易患坏血病,故C错误;
D.维生素D促进钙、磷吸收和骨骼发育,缺乏易患佝偻病、骨质疏松等,故D错误.
故选B.
点评 本题考查人体必需的维生素的主要来源及其摄入途径,侧重于常识性内容的考查,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
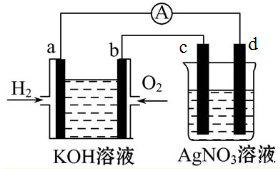
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应一定不能实现 | |
| B. | 自发反应在任何条件下都能实现 | |
| C. | 同种物质气态时熵值最小,固态时熵值最大 | |
| D. | 对于2N2O5(g)?4NO2(g)+O2(g)△H>0,在室温下能自发进行是因为反应是熵增的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③ | C. | ①④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com