
| A. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ca(HCO3)2溶液与少量的NaOH溶液混合2HCO3-+Ca2++2OH-═2 H2O+CaCO3↓+CO32- | |
| C. | 磁性氧化铁溶液与稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | NH4HCO3溶液与过量的NaOH溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.次氯酸为弱电解质,保留化学式;
B.氢氧化钠少量反应生成碳酸钙、碳酸氢钠和水;
C.硝酸根离子具有强的氧化性能够氧化二价铁离子;
D.漏掉碳酸氢根离子与氢氧根离子的反应.
解答 解:A.将氯气通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.Ca(HCO3)2溶液与少量的NaOH溶液混合,离子方程式Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.磁性氧化铁溶液与稀硝酸,离子方程式:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故C正确;
D.NH4HCO3溶液与过量的NaOH溶液混合共,离子方程式:NH4++HCO3-+2OH-═NH3↑+H2O+CO32-+H2O,故D错误;
故选:C.
点评 本题考查熟练掌握离子共存的条件、离子方程式的书写原则是解题关键,注意化学式的拆分、原子个数、电荷数守恒规律,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
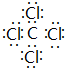 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中有杂质Na2SO4(适量的BaCl2溶液) | |
| B. | FeSO4溶液中有杂质CuSO4 (Fe粉) | |
| C. | CO2气体中有少量CO(灼热的氧化铜) | |
| D. | SO2气体中有少量HCl气体(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
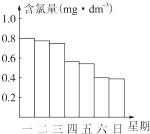
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 1使溴的四氯化碳溶液褪色;②比例模型为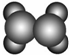 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为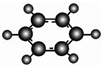 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为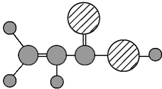 |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$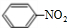 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com