
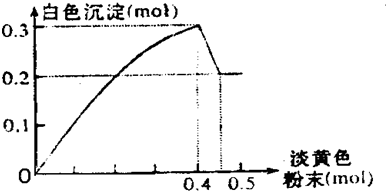
分析 淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,据此分析解答.
解答 解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,
(1)由上述分析可知,淡黄色固体为:Na2O2,名称为过氧化钠,故答案为:过氧化钠;
(2)由上述分析可知,溶液中肯定有离子NH4+、Al3+、Mg2+,肯定没有Fe3+和Cu2+离子,
故答案为:NH4+、Al3+、Mg2+;Fe3+和Cu2+;
(3)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=0.2mol,n(Al3+)=0.3mol-n[Mg(OH)2]=0.1mol.
当n(Na2O2)=0.4mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=0.4mol×$\frac{1}{2}$=0.2mol,所以
n(NH4+)=n(NH3)=0.3mol-n(O2)=0.1mol,
故n(Mg2+):n(Al3+):n(NH4+)=0.2mol:0.1mol:0.1mol=2:1:1,
故答案为:n(Mg2+):n(Al3+):n(NH4+)=2:1:1;
(4)①由上述分析可知,淡黄色固体为:Na2O2,与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②沉淀部分减少即为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,
离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会导致氨气逸出.


科目:高中化学 来源: 题型:选择题
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A. | Cu与Al | B. | Fe与Cu | C. | Fe与Na | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请完成下列各题
请完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
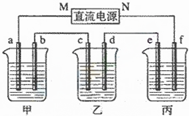 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | K+ | C. | SO32- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向某未知溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 用一束强光照射Na2SiO3溶液 | 溶液中出现一条光亮的通路 | 溶液中可能含有硅酸胶体 |
| C | 向盛有Fe(NO3)2溶液的试管中滴入几滴0.1mol/LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 淀粉溶液中加稀硫酸,加热片刻后再滴加银氨溶液,并用水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com