
【题目】(1)在催化剂作用下,CO2和H2可以制取甲醇.用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2![]() CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: .
(2)硼氢化钠(NaBH4)是有机合成中的重要还原剂.最新研究发现,以NaBH4(硼元素的化合价在该过程中不发生变化)和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

电极b为 (填“正极”或“负极”),
电极a上发生反应的电极反应式为 .
(3)电池工作时,Na+向 极(填“a”或“b”)移动,
当左槽产生0.0125mol BO2﹣离子时,右槽溶液c(OH-)
【答案】(1)CO2(g)+3H2(g)═CH3OH(l)+H20(l)△H=﹣50kJ/mol
(2)正极 BH4﹣+8OH﹣﹣8e﹣=BO2﹣+6H2O
(3)b 0.1mol/L
【解析】
试题分析:(1)图象分析书写热化学方程式为:①CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ/mol,②CO(g)+2H2(g)=CH3OH(l)△H=-91KJ/mol;依据盖斯定律②-①得到:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol。
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)根据图示内容,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O。
故答案为:正;BH4-+8OH--8e-=BO2-+6H2O;
(3)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,根据电极反应:BH4-+8OH--8e-=BO2-+6H2O,当左槽产生0.0125mol BO2-离子时,转移电子是0.1mol,此时根据正极上电极反应H2O2+2e-=2OH-,则生成氢氧根离子的物质的量是0.1mol,则氢氧根离子浓度是0.1mol/L。
故答案为:b;0.1mol/L。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】阿斯巴甜(APM)是一种较适合糖尿病患者食用的蔗糖代替品,其一种合成路线如图,其中A、B、C、D、E均为有机物,部分反应条件和产物已略去.
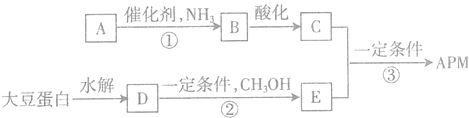
已知:①由C、H、O三种元素组成的二元羧A,相对分子质量为116,其羧连接在不同碳原子上,且核磁共振氢谱有两个面积相等的吸收峰.
②C、D所含官能团相同;D为单取代芳香化合物,是大豆蛋白水解的最终产物之一,其分子式为C9H11NO2,且分子中不含甲基.
回答下列问题:
(1)A的分子式为___________,结构简式为___________。
(2)反应①的化学方程式为___________ ,C中所含官能团的名称为___________。
(3)D通过醋化反应生成E,反应的化学方程式为___________。
(4)APM是一种二肽,上述过程中APM可能的结构简式为___________和___________。
(5)D物质的同分异构体有多种,能同时满足下列条件的共有___________种(不含立体异构).
①苯环上有两个取代基 ②分子中含有硝基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子 B.SO42-、NH4+一定存在,Cl-可能不存在
C.Cl-一定存在,且c(Cl-)≥0.4 mol/L D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
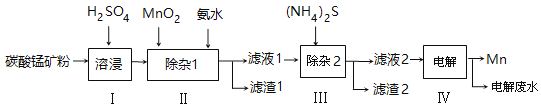
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化及海水资源的提取利用是当今化工行业重要课题。
回答下列问题:
(1)下列属于海水淡化常见工艺的是________(填序号)。
①电渗析法 ②蒸馏法 ③离子交换法 ④沉淀法
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是 Br2+Na2CO3+H2O→ NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子为________mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为____________________________________________,产品2 的化学式为________,1 L 浓海水最多可得到产品2 的质量为________g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:_______________。电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2S 可用于制防污涂料,其可由热的铜在硫蒸气或H2S 中反应制得。
(1)铜元素在元素周期表中的位置为 ____________,Cu+的核外电子排布式为_________,基态铜原子核外电子共有__________种运动状态。
(2)Cu2S在一定条件下可被氧化为CuSO4。
①在SO42—中S原子的杂化轨道类型为________;SiO44—、PO43—与 SO42—互为________;其中Si、P、S第一电离能由大到小顺序为________________ ;
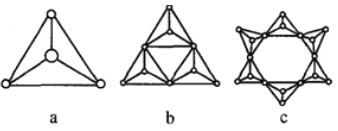
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图a 表示,图中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式_______________。
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如下:
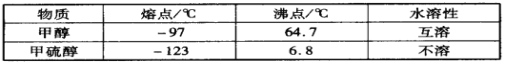
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是__________________________。
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如下图所示(1 pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=_________g/cm3(保留三位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素。请回答:
(1)基态Si原子的价层电子排布图为 ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为 。
(2)ClO3-、ClO4-中Cl都是以 轨道与O原子 轨道成键,其微粒的立体结构分别为 、 。
(3)N和Si形成的原子晶体中,N原子的配位数为 。
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色。大多数金属元素有焰色反应的微观原因为 ;N3-中σ键和π键的数目之比为 。B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为 (用元素符号表示)
(5)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成。则:
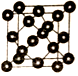
①晶胞中最小的环含有_____个原子。
②若晶体密度为ρg·cm3,阿伏伽德罗常数为NA,晶胞中两个最近的Si原子核之间的距离为____pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸,乳酸的结构简式为![]() 。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
(1)写出乳酸分子中官能团的名称 。
(2)一定条件下乳酸能发生的反应类型有______________ (填序号)。
A.水解反应
B.取代反应
C.加成反应
D.中和反应
E.氧化反应
F.酯化反应
(3)写出过量乳酸与碳酸钠溶液反应的化学方程式 。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此有机生成物的结构简式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com