

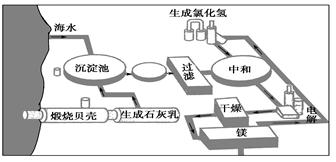
|
 Mg+Cl2↑(2)氯气 (3)为了防止氯化镁水解,要在氯化氢气体的氛围中加热
Mg+Cl2↑(2)氯气 (3)为了防止氯化镁水解,要在氯化氢气体的氛围中加热 Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。
Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。

科目:高中化学 来源:不详 题型:单选题
| A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 |
| B.Cu的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜 |
| C.Fe通常采用热还原法冶炼,加入石灰石的目的是除去过量的碳 |
| D.由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
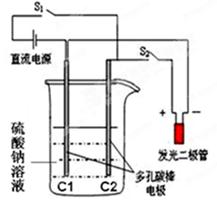
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
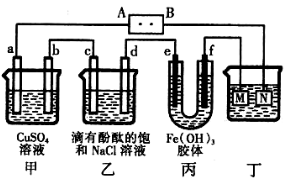
| A.电源B端是正极 |
| B.a、c电极均有单质生成,其物质的量之比为2:1 |
| C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液 |
| D.f极附近变红,说明氢氧化铁胶粒带正电荷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl、CuCl2、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.NaOH、H2SO4、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
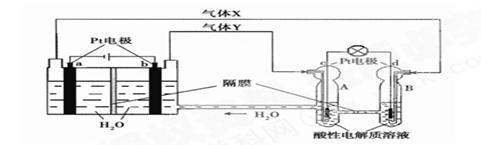
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com