
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.则2E1>E2 |
| C、l0lkPa 时,2H2(g)+O2(g)=2H2O(1);△H=-571.6kJ?mol-1,H2的燃烧热为571.6kJ/mol |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,含 1molNaOH 的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |


科目:高中化学 来源: 题型:
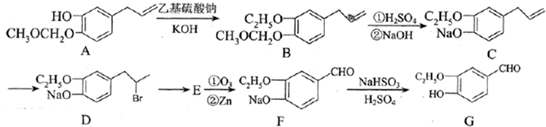
| ①O3 |
| ②Zn |
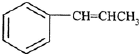 为原料制备
为原料制备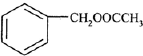 的合成路线流程图(无机试剂
的合成路线流程图(无机试剂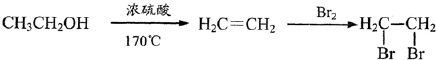
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、将pH相同的盐酸和醋酸稀释相同倍数,醋酸的pH变化大 |
| C、10 mL0.10 mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH都相同HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡后,若使用催化剂,C的体积分数将增大 |
| B、当平衡后,若温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中,n>e+f |
| D、达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③④ |
| C、②③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | ||
| B、由“C(石墨)=C(金刚石);△H=+119kJ?mol-1”可知,金刚石比石墨稳定 | ||
| C、在稀溶液中:H+(aq)+OH q)=H2O(l);△H=-57.3l kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ | ||
D、在101KPa时,2g H2生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com