
| A. | 稀硫酸与氢氧化钾溶液反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 锌与稀硫酸的反应 | D. | 生石灰变成熟石灰的反应 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、C或氢气作还原剂的氧化还原反应、少数分解反应以及某些复分解(如铵盐和强碱),以此来解答.
解答 解:A.稀硫酸与氢氧化钾溶液反应,为中和反应,属于放热反应,故A不选;
B.Ba(OH)2•8H2O与NH4Cl反应,为吸热反应,故B选;
C.锌与稀硫酸的反应,为金属与酸的反应,属于放热反应,故C不选;
D.生石灰变成熟石灰的反应,为放热反应,故D不选;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、常见的吸热反应为解答的关键,侧重分析与应用能力的考查,注意归纳常见的吸热反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 燃料电池可将热能直接转变为电能 | |
| C. | 较长时间不使用电器时,最好从电器中取出电池,并妥善存放 | |
| D. | 铅蓄电池放电时,负极是Pb,正极是PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 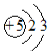 可以表示10B的原子结构,但不能表示11B的原子结构 可以表示10B的原子结构,但不能表示11B的原子结构 | |
| B. | 聚乙烯的结构简式:-[CH2-CH2]- | |
| C. | CH4的球棍模型: | |
| D. | 次氯酸分子的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.2 mol NH3 | |
| B. | 压缩体积,增大压强能使反应速率减小 | |
| C. | 降低反应体系的温度能加快反应速率 | |
| D. | 容器体积不变,向容器中再加入N2,能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子其核外全部都是s电子 | |
| B. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s2p6的离子 | |
| C. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com