


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(11分)某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
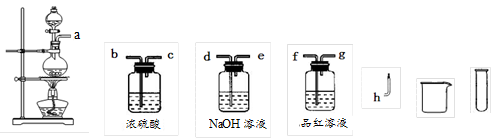
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011年甘肃省兰州一中高考化学模拟试卷(四)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(十九)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com