
| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
分析 向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积.
解答 解:生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,即Cu提供电子为:$\frac{1.68L}{22.4L/mol}$×4=0.3mol,
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,故n(NaOH)=0.3mol,故消耗氢氧化钠溶液体积为$\frac{0.3mol}{3mol/L}$=0.1L=100mL,
故选A.
点评 本题考查混合物计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.


科目:高中化学 来源: 题型:解答题
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
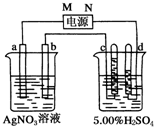 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
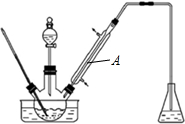
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
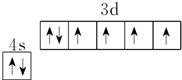 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com