
| 试剂Z | 离子X | 离子Y |
| A.NH3.H2O B.AgNO3 C.Na2SO4 D.Ba(NO3)2 | Al3+ Cl- Ba2+ SO42- | Mg2+ CO32- Mg2+ Cl- |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、向FeCl2 溶液中逐滴加入NaOH溶液 |
| B、向FeSO4溶液中逐滴加入氨水 |
| C、先将盛有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2的白色沉淀 |
| D、取新配制的FeSO4溶液适量放入试管中,在加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
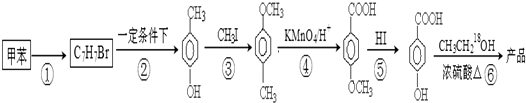
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
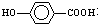
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)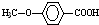 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有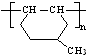 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、HCO3-的电离程度大于HCO3-水解程度 |
| D、存在的电离有NaHCO3=Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
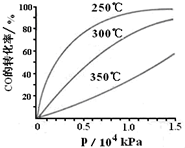 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ K+ OH- Cl- |
| B、Na+ Cu2+ SO42- NO3- |
| C、Mg2+ Na+ SO42- Cl- |
| D、Ba2+ HCO3- NO3- K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com