
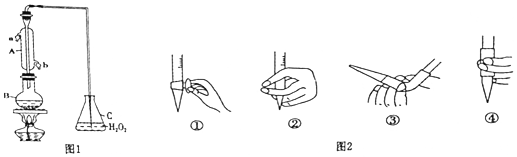
分析 (1)根据仪器A特点书写其名称;
(2)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式;
(3)氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;
(4)根据滴定终点时溶液的pH及常见指示剂的变色范围选用正确的指示剂;
(5)根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.
解答 解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:冷凝管或冷凝器;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法,
故答案为:③;
(4)滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);
故答案为:酚酞;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:盐酸易挥发.
点评 本题为一道高考题,考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
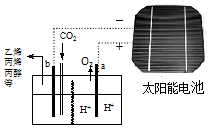 以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )| A. | 该装置中能量转化形式至少有两种 | |
| B. | 点解完成后溶液的C(H+)略增大 | |
| C. | 如生成的氧气在标准状况下的体积为22.4L,则透向a极迁移的H+数目为4NA | |
| D. | 如生成乙烯,则b极的反应为:2CO2+12e-+12H+=C2H4+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
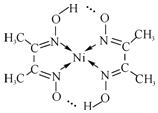
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题: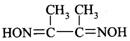 )常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
)常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入NaOH溶液,产生白色沉淀,则原溶液一定含有Mg2+ | |
| B. | 滴入BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液一定含有SO42- | |
| C. | 滴入稀硫酸产生无色无味使澄清石灰水浑浊的气体,则原溶液一定含有CO32- | |
| D. | 滴入KSCN溶液呈无色,再通入少量Cl2后呈红色,则原溶液一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
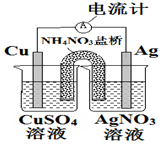
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
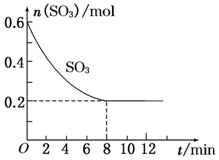 在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 增大体积 | C. | 加负催化剂 | D. | 补充 He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
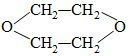
| A. | 乙烯 | B. | 1-丁稀 | C. | 1,3-丁二烯 | D. | 乙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com