
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素的名称为____,生成1 mol O2时转移电子的数目是________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称:________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为________。
(5)用双线桥法标明MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
【答案】氧 4NA 过滤 MnO2+4H+2Cl-![]() Mn2++Cl2↑+2H2O 1:2
Mn2++Cl2↑+2H2O 1:2 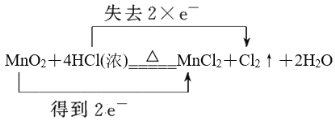
【解析】
反应2KClO3![]() 2KCl+3O2↑中Cl元素化合价由+5价变成-1价,O元素化合价由-2价变成0价,反应MnO2+4HCl(浓)
2KCl+3O2↑中Cl元素化合价由+5价变成-1价,O元素化合价由-2价变成0价,反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价,氯元素化合价从-1价升高到0价,结合物质的性质、氧化还原反应的有关概念、电子得失守恒以及反应的方程式分析解答。
MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价,氯元素化合价从-1价升高到0价,结合物质的性质、氧化还原反应的有关概念、电子得失守恒以及反应的方程式分析解答。
(1)O元素化合价由-2价变成0价,化合价升高失去电子被氧化,因此该反应中被氧化的元素的名称为氧;生成1mol O2时转移4mol电子,数目为4NA;
(2)从反应后的固体混合物中分离出难溶于水的MnO2应该采用过滤的方法;
(3)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的离子方程式为MnO2+4H+2Cl-
MnCl2+Cl2↑+2H2O的离子方程式为MnO2+4H+2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)反应2KClO3![]() 2KCl+3O2↑中生成3mol氧气转移12mol电子,反应MnO2+4HCl(浓)
2KCl+3O2↑中生成3mol氧气转移12mol电子,反应MnO2+4HCl(浓)![]() Cl2↑+MnCl2 +2H2O中生成1mol氯气转移2mol电子,则转移12mol电子时生成6mol氯气,所以转移电子的物质的量相同时生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
Cl2↑+MnCl2 +2H2O中生成1mol氯气转移2mol电子,则转移12mol电子时生成6mol氯气,所以转移电子的物质的量相同时生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
(5)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价得到2个电子,氯元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知转移电子数为2个,则电子转移的方向和数目可表示为
MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价得到2个电子,氯元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知转移电子数为2个,则电子转移的方向和数目可表示为 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气反应生成NO2
C.CO2与NO反应生成NO2
D.NO与H2O反应生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为制取有机物Z的反应,下列说法正确的是
![]()
A. X、Y均能发生取代反应,Z不能发生 B. X、Y、Z中只有X的所有原子可能共面
C. X、Y均可作为合成聚合物的单体 D. Y的同分异构体的数目只有2种(不包括本身)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,用TiO2制取Ti的主要反应有①TiO2+2C+2Cl2![]() TiCl4+2CO、②TiCl4+2Mg
TiCl4+2CO、②TiCl4+2Mg![]() 2MgCl2+Ti。下列叙述正确的是
2MgCl2+Ti。下列叙述正确的是
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是 ( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3- D. H+、K+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。

填写下列空白:
(1)写出化学式:A______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)反应③的化学方程式中:氧化剂是________还原剂是_________
(4)写出反应②的化学方程式:并用双线桥法标出电子转移方向和数目________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A. 标准状况下,1.12L 1H2和0.2g2H2均含有0.1NA个质子
B. 1mol Na2CO3晶体中含有的CO32-数目一定为NA
C. 常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA
D. 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com