
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:
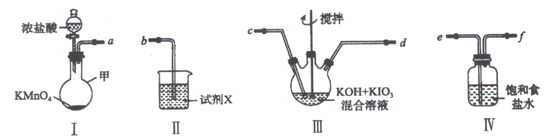
(1)装置I中盛放浓盐酸的仪器名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X的作用___________。
(4)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(5)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取a g该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为b L。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O;KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O;I2+2Na2S2O3===2NaI+N2S4O6则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
【答案】分液漏斗 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ 处理尾气氯气 aefcdb 2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失
KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失 ![]() 100%
100%
【解析】
装置I为氯气的发生装置,用于提供氯气来氧化碘酸钾制备高碘酸钾,装置I后接装置IV,用于除去挥发出的HCl气体,保证制备高碘酸钾的体系为碱性环境,而后接装置III,用于制备高碘酸钾,最后接装置II,用于处理尾气,装置II中应为NaOH溶液。
(1)装置I中盛放浓盐酸的仪器名称是分液漏斗;
(2)根据氧化还原反应得失电子守恒、电荷守恒、原子守恒,可写出装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;
(3)根据分析,装置Ⅱ中的试剂X为NaOH,作用为尾气处理;
(4)根据分析,以及气体进入反应装置应当长导管进、短导管出,可写出接口顺序为aefcdb;
(5)①根据氧化还原反应得失电子守恒、电荷守恒、原子守恒,可写出装置Ⅲ中发生反应的化学方程式为2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O;
KIO4+2KCl+ H2O;
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是可以降低KIO4的溶解度,减少晶体损失;
③由题意可知,滴定消耗的硫代硫酸钠的物质的量为b mol,所以碘单质的物质的量为0.5b mol,设样品中高碘酸钾的物质的量为x,碘酸钾的物质的量为y,![]() ,
,![]() ,解得
,解得![]() ,整理化简后可得该产品中KIO4的百分含量是
,整理化简后可得该产品中KIO4的百分含量是![]() 100%。
100%。


科目:高中化学 来源: 题型:
【题目】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__。
(2)浓硫酸与铜共热,化学方程式为__,浓硫酸表现的性质是__。
(3)浓硫酸与红热木炭反应,化学方程式为__,浓硫酸表现的性质是__。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
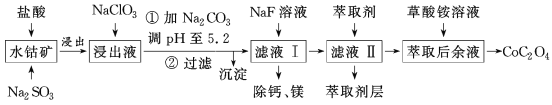
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
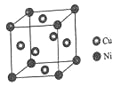
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述错误的是( )

A.H3BO3在水溶液中发生H3BO3+H2O![]() H++[B(OH4)],可知H3BO3是一元弱酸
H++[B(OH4)],可知H3BO3是一元弱酸
B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子
C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,lmolNH4BF4含有配位键的数目为NA
D.由B2O3可制备晶体硼,晶体硼的熔点2573K,沸点2823K,硬度大,属于共价晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
②Fe与稀硫酸反应制取H2时,改用98%浓硫酸
③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液
④在K2SO4与BaCl2两溶液反应时,增大压强
⑤2SO2+O2![]() 2SO3 ΔH<0,升高温度
2SO3 ΔH<0,升高温度
⑥Na与水反应时,增大水的用量
⑦2H2O2==2H2O+O2↑反应中,加入少量MnO2
⑧H2与Cl2混合后,光照
A.①②③④⑤B.①③④⑤⑥C.①③⑤⑦⑧D.①③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru配合物与g—C3N4复合光催化剂将CO2还原为HCOOH的原理示意图如图。
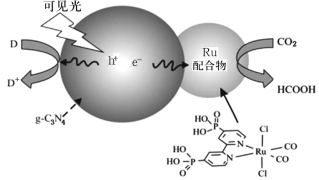
(1)Ru基态原子价电子排布式为4d75s1,写出该元素在元素周期表中的位置___,属于___区。
(2)HCOOH中σ键与π键的数目之比是___,HCOOH的沸点比CO2高的原因___。
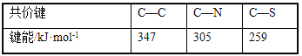
(3)紫外光的光子所具有的能量约为399kJ·mol1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因__。
(4)已知![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
(5)下列状态的氮、氧原子中,电离最外层一个电子所需能量最大的是___(填序号,下同),最小的是___(填序号)。
A.氮![]()
B.氧![]()
C.氧![]()
D.氧![]()
(6)一种类石墨的聚合物半导体g—C3N4,其单层平面结构如图1,晶胞结构如图2。
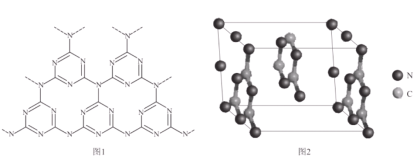
①g—C3N4中氮原子的杂化类型是__;
②根据图2,在图1中用平行四边形画出一个最小重复单元___;
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部,设阿伏加德罗常数的值为NA,则g—C3N4的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究温度对一氧化碳还原氧化铁的影响。
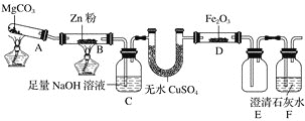
(1)MgCO3的分解产物为____________。
(2)装置C的作用是______________,处理尾气的方法为______________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒类喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验。已知Fe2+与K3[Fe(CN)6](铁氰化钾)溶液反应生成带有特征蓝色的铁氰化亚铁沉淀。

①乙组得到的黑色粉末是______________。
②甲组步骤1中反应的离子方程式为______________。
③乙组步骤4中,溶液变红的原因为______________________;溶液褪色可能的原因及其验证方法为________________________。
④从实验安全考虑,题图装置还可采取的改进措施是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com