
某校化学研究性学习小组的同学探究以铜为电极电解电解质溶液的情况,
第一组同学以铜为电极电解饱和食盐水,探究过程如下:
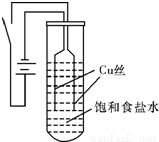
【实验Ⅰ】如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10;随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,但溶液始终未出现蓝色。
【实验Ⅱ】将实验Ⅰ中试管底部的橙黄色沉淀取出,分装在两支小试管中,沉淀很快转变为砖红色,后续的操作及现象如下:

请回答下列问题:
(1)聚集在试管底部的橙黄色沉淀的化学式为______________.
(2)阳极的电极反应式为______________.
(3)写出实验Ⅱ中①、②的离子方程式:①__________;②__________.
(4)第二组同学将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min.画出下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图,其中正确的是( )
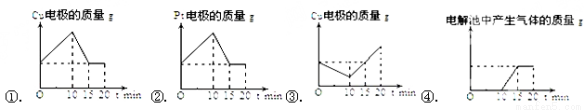
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上9月月考化学试卷(解析版) 题型:选择题
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)  cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A.平衡正移 B.(a+b)>(c+d) C.Z的体积分数变小 D.X的转化率变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:填空题
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
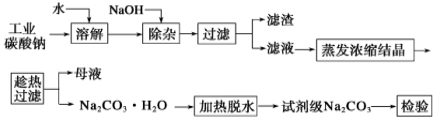
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:

回答下列问题:
(1)滤渣的主要成分为_____________________________。
(2)“趁热过滤”的原因是_________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是________(写出一种)。
(4)已知:Na2CO3·10H2O (s)===Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液  D.不用铁片,改用铁粉
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
电解CuSO4溶液时,要求达到三点(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是
A.纯铜作阳极,含Zn和Ag的铜合金作阴极
B.含Zn和Ag的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,纯铜作阴极
D.用石墨作阳极,纯铜作阴极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示.电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况).则下列说法中正确的是( )
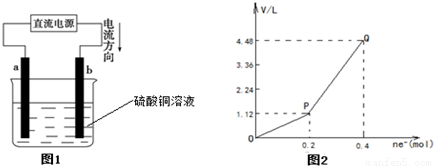
A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生
B.从开始到Q点时收集到的混合气体的平均相对分子质量为17
C.曲线OP段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化
D.a电极上发生反应的方程式为:2H++2e-═H2↑和4OH--4e-═2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
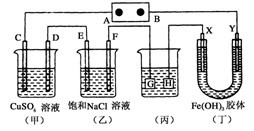
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:3:2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)  Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上入学考试化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。试回答下列问题:
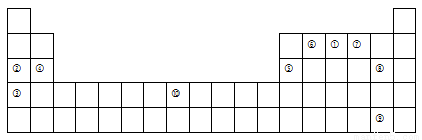
(1)写出表中⑥含有8个中子的原子的化学符号 ,元素⑦的氢化物与⑧的单质反应的离子方程式为 。
(2)元素⑩的核外电子排布式 。
(3) 根据元素周期表来比较④和Cs的金属性,要通过另一种元素作中介或桥梁进行比较, 这种元素是 (填元素符号)。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月根据①合成了一种名为“N5”的物质,由于其极强的爆炸性,又称“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键,则“N5”分子碎片的电子式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com