
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A、对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
B、氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
C、碳酸的电离分步进行,以第一步为主,则碳酸氢根离子浓度大于碳酸根离子;
D、依据溶液中物料守恒分析判断;
解答 解:A、在相同的条件下测得①CH3COONa,②NaHCO3,③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即①>②>③,溶液的c(Na+):①>②>③,故A正确;
B、含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C、H2CO3的第一步电离大于第二步电离,则c(H+)>c(HCO3-)>c(CO32-),但c(HCO3-)不等于2c(CO32-),故C错误;
D、含等物质的量的NaHC2O4和Na2C2O4的溶液中,2n(Na)=3n(C2O42-),溶液中2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D错误;
故选A.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.


科目:高中化学 来源: 题型:填空题
 ,属于共价(“离子”或“共价”)化合物.
,属于共价(“离子”或“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
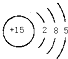 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
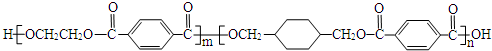
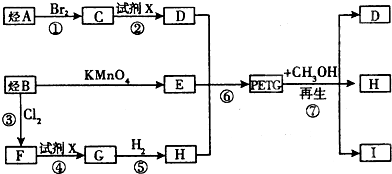
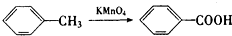

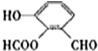
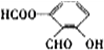 、
、 、
、
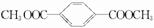 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
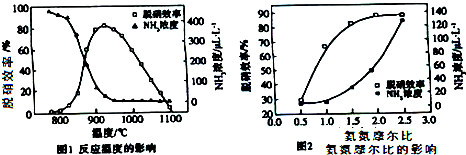
| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:Z一定高于Y | |
| B. | 最高价氧化物对应水化物的酸性:X强于Y | |
| C. | W、X、Y、Z都能分别与氯元素形成共价化合物 | |
| D. | 仅由W、Y、Z三种元素组成的化合物不可能属于盐类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化转化器中的铂催化剂可加快CO的氧化 | |
| B. | 铂表面做成蜂窝状更有利于提高催化效果 | |
| C. | 在铂催化下,NO、NO2可被CO还原成N2 | |
| D. | 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
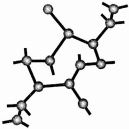 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com