
| A. | AgCl是氧化产物 | |
| B. | 每生产1mol Na2Mn5O10转移3mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 正极反应式:Ag+Cl--e-═AgCl |
分析 根据海水中电池总反应5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl可知,Ag失电子发生氧化反应作负极,MnO2作正极,负极反应式为Ag+Cl--e-═AgCl,正极反应式为5MnO2+2e-=Mn5O102-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此解答.
解答 解:A.Ag失电子作还原剂,则AgCl是氧化产物,故A正确;
B.根据5MnO2+2e-=Mn5O102-可知,每生成1molNa2Mn5O10转移2mol电子,故B错误;
C.电解质溶液中阳离子向正极移动,阴离子向负极移动,所以Na+不断向“水”电池的正极移动,故C错误;
D.负极反应式为Ag+Cl--e-═AgCl,正极反应式为5MnO2+2e-=Mn5O102-,故D错误;
故选A.
点评 本题考查原电池的工作原理,为高频考点,涉及电极反应、离子的定向移动、电化学的简单计算,分析Mn元素的化合价变化是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任意位置寻找 | B. | 稀有气体元素中寻找 | ||
| C. | 金属和非金属的分界线处寻找 | D. | 活泼金属和活泼非金属区中寻找 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
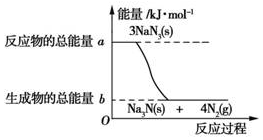 减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.
减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验淀粉是否水解 | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热沸腾 |
| D | 证明SO2有漂白性 | 将SO2通入酸性高锰酸钾溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
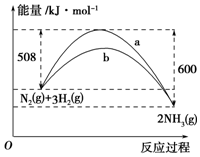 如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.
如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com