
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
分析 反应2Fe2++H2O2+2H+═2Fe3++2H2O中,Fe2+被H2O2氧化生成Fe3+,
反应2Fe3++H2O2═2Fe2++O2↑+2H+中,Fe3+被H2O2还原生成Fe2+,Fe2+可为H2O2分解的催化剂,以此来解答.
解答 解:A.由(1)可知Fe2+被H2O2氧化生成Fe3+可知,H2O2的氧化性比Fe3+强,其还原性比Fe2+弱,故A正确;
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,双氧水溶液本身是弱酸性,而分解生成的水是中性,溶液的H+浓度减小,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 化石燃料属于可再生能源,不影响可持续发展 | |
| B. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 氢气燃烧热高,其燃烧产物是水,是一种理想的清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在体积可变的密闭容器中发生可逆反应 A(g)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | |
| B. | 对于反应 C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率可能减小 | |
| C. | 向 0.1 mol•L-1的氨水中加入氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}0)}$增大 | |
| D. | 常温下,向 Mg(OH)2悬浊液中加入 MgCl2浓溶液后,溶液中$\frac{c(M{g}^{2+})•c(O{H}^{-})}{c({H}^{+})}$不变(一定温度下,Mg(OH)2悬浊液中 c(Mg2+)﹒c2(OH-)为定值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
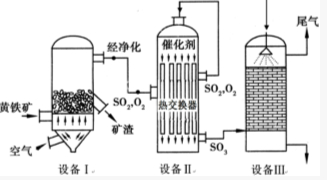 以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+O2↑ | |
| B. | 氯化铁溶液和氢氧化钠溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH4Cl | B. | 0.1 mol N2 | ||
| C. | 1.204×1022个CO(NH2)2 | D. | 0.2mol NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com