
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
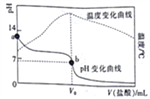
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
【答案】D
【解析】A. a点为0.1000mol/LMOH溶液,存在电荷守恒,c(OH-)=c(M+)+c(H+),故A正确;B. b点溶液显酸性,若V。=20.00mL,则恰好生成MCl,水解显酸性,与图像吻合,故B正确;C. 298K时,MOH的电离平衡常数Kb=1.0×10-5,0.1000mol/LMOH溶液中,1.0×10-5=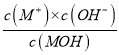 =
=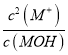 =
=![]() ,则c(M+)=1.0×10-3,因此MOH的电离度a=
,则c(M+)=1.0×10-3,因此MOH的电离度a=![]() ×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5=
×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5=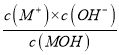 =
=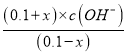 ,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。
,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式是________________________,常温下单质为液态的非金属单质是____________。
(2)元素④的离子结构示意图为__________________。
(3)①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________________。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________________。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E元素在周期表中位于第____周期_____族;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式),原因是:_______。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A. 1mol乙酸、乙醇和甲酸甲酯的混合物中含有的碳原子数为2NA
B. 46gNa与一定量O2完全反应生成Na2O和Na2O2时转移的电子数为3NA
C. 0.5L1mol·L-1的NaHS溶液中含有的HS-、S2-的总数为0.5NA
D. 2molNO和1molO2充分反应后,体系中含有的NO2分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①③⑤
B.①②③
C.②④
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃甲酸是抗菌素一种,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
![]()
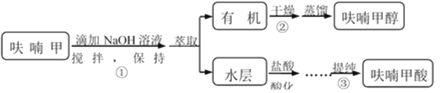
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融,230-232℃沸腾,并在此温度下脱羧;
②呋喃沸点为31-32℃,易溶于水;
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、______和______。
(2)步骤②中干燥所使用的干燥剂可选用______。
A.98%浓硫酸 B.无水硫酸镁
C.无水碳酸钠 D.无水氯化钙
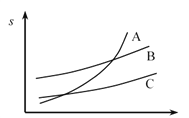
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(s)随温度变化的曲线如图:步骤③提纯时,合适的溶解溶剂是______,其理由______。
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。
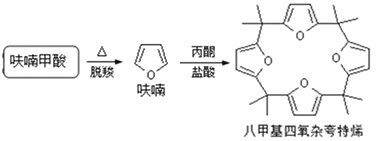
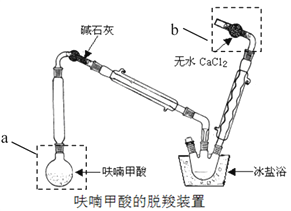
①仪器a的名称:______,装置b的作用:______,
②脱羧装置中用冰盐浴的目的是______;
③确定产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有______。
④若用4.5g呋喃甲酸制得了0.5g八甲基四氧杂夸特烯(M=432g·mol-1),则产率为______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(1)写出甲中正极的电极反应式___________________。
(2)乙中负极材料为___________________,乙中总反应的离子方程式:___________________。
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___________________活动性更强,而乙会判断出___________________活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有___________________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的是
A.Na+、Fe3+、SO42-、SCN-B.K+ 、OH-、AlO2-、Cl-
C.H+ 、Na+、Fe2+、MnO4-D.Na+、H+、HCO3-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com