
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
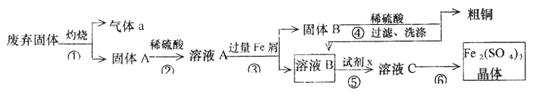
(1)除酒精灯和铁架台或三脚架外,①中所需的容器为_______;①和⑥中都用到的玻璃仪器为______________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol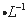 硫酸、1.0 mol
硫酸、1.0 mol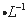 NaOH溶液、0.1 mol
NaOH溶液、0.1 mol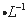 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
【知识点】化学实验操作 J1 J2
【答案解析】

解析::(1)①灼烧固体应该放在坩埚中,坩埚用坩埚钳夹持;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体都用到玻璃棒,
故答案为:坩埚;坩埚钳; 玻璃棒;
(2)由于加入试剂x目的是氧化亚铁离子,使用试剂不能引进新的杂质,所以选用双氧水做氧化剂,反应方程式:2Fe2++H2O2 +2H+=2Fe3++2H2O
(3)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理
【思路点拨】本题借助氯化铁固体的制取,考查了实验操作中仪器名称、试剂选择、硫酸铁溶液配制、检验方案的试剂、离子方程式书写等知识,题目综合性较强,充分考查了学生的分析、理解能力,本题难度中等.


科目:高中化学 来源: 题型:
关于下列诗句或谚语,说法不正确的是 ( )
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C.“滴水石穿,绳锯木断”不包含化学变化
D.“落汤螃蟹着红袍”肯定发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究SO2的漂白作用到底是SO2本身还是SO2与水作用的产物,某学习小组设计了如图装置来进行实验。请回答相关问题。
(1)制备SO2气体的反应方程式为: ;
发生装置的玻璃仪器名为 、 ;
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。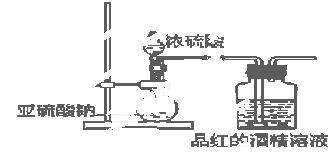
① ;② ;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) 。
(4)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,对此他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由是 。
(5)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,再分别一次性加入20ml 0.1mol/L的Na2SO3溶液、20ml 0.1mol/L的NaHSO3溶液,发现加入Na2SO3溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容:
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面_________ | 较上面_______ | 较上面_______ | 慢 |
②根据实验和分析,得出的结论是
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
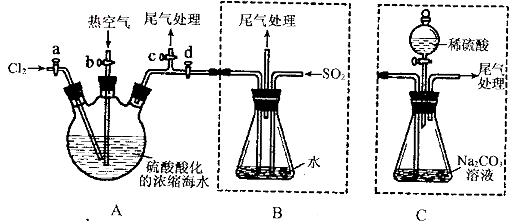
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
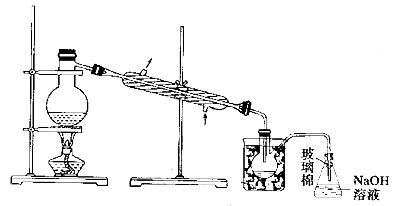
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A.【物质结构与性质】
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN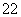 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
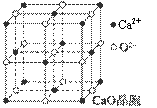

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1①
P(红磷,s)+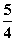 O2(g)===
O2(g)===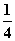 P4O10(s) ΔH2=-738.5 kJ·mol-1②
P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为____________________________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.44.2 kJ·mol-1
C.-330 kJ·mol-1 D.330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com