
| A. | pH=4的氯化铵溶液中:c(H+)=c(NH3•H2O )=1×10-4mol•L-1 | |
| B. | pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<② | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1 |
分析 A.NH4+水解生成NH3•H2O,且水解程度不大,水解显酸性;
B.NaOH抑制水的电离,而NaClO促进水的电离;
C.等体积混合后,溶液的溶质为NaF、HF,溶液显酸性;
D.HCl为强酸,稀释10倍后,pH增大1个单位.
解答 解:A.NH4+水解生成NH3•H2O,且水解程度不大,水解显酸性,则c(H+)=1×10-4mol•L-1>c(NH3•H2O ),故A错误;
B.NaOH抑制水的电离,而NaClO促进水的电离,则两种溶液中水的电离程度:①<②,故B正确;
C.等体积混合后,溶液的溶质为NaF、HF,溶液显酸性,则离子浓度为c(F-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.HCl为强酸,稀释10倍后,pH增大,则pH=a的HCl溶液,稀释10倍后,其pH=b,可知a=b-1,故D正确;
故选BD.
点评 本题考查离子浓度的比较及盐类水解,为高频考点,把握电离与水解、酸碱混合后离子浓度关系为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为NA | |
| C. | 标准状况下,2.24L NH3与1.6g CH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的饱和HCOONa溶液、CH3COONa溶液的pH | HCOONa的pH<CH3COONa的pH | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向5ml 2mol•L-1NaOH溶液中加入1ml 1mol•L-1CuSO4溶液,振荡后加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
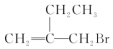
| A. | 该物质可以发生水解反应 | |
| B. | 该物质能和AgNO3溶液反应产生AgBr沉淀 | |
| C. | 该物质可以发生消去反应 | |
| D. | 该物质不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | X | Y |
| Z | W |
| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8 | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、W | |
| D. | RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com